

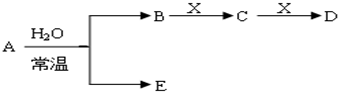
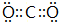 ,表示X呈碱性的离子方程式为:CO32-+H2O?HCO3-+OH-,
,表示X呈碱性的离子方程式为:CO32-+H2O?HCO3-+OH-,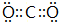 ;CO32-+H2O?HCO3-+OH-;
;CO32-+H2O?HCO3-+OH-;| 1mol×32g/mol |
| 1.6g |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH为9的Na2CO3溶液和pH为5的NaHSO4溶液中,水的离程度相同 |
| B、在含Al3+的KNO3溶液中,可通过加热法除去Al3+,证明盐的水解是吸热反应 |
| C、已知HF的酸性比HCN的酸性强,则等体积等浓度NaF和NaCN两溶液中阳离子的物质的量之和相等 |
| D、等物质的量浓度的①NH4Cl ②NH4HSO4 ③Na2S ④NaNO3 ⑤(NH4)2SO4,其pH由大到小的排列为③>④>⑤>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 结论 |
| A | 用洁净的铂金丝沾取硫酸盐在酒精灯上灼烧,焰色为黄色 | 该硫酸盐一定含Na+ 一定不含K+ |
| B | 二氧化硫通入Ba(NO3)2溶液有白色沉淀生成,试管口出现浅红棕色气体 | 酸性条件下NO3-具有强氧化性 |
| C | 在淀粉的水解液中加入新制Cu(OH)2悬浊液加热,无红色沉淀 | 淀粉没有发生水解 |
| D | 某试样溶液中加入少量稀盐酸,有白色沉淀生成 | 试样中一定含有Ag+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、通常情况下,X元素只存在两种氧化物 |
| B、Y元素气态氢化物的还原性最强 |
| C、X元素的非金属性比Y元素非金属性强 |
| D、W的最高价氧化物对应水化物的酸性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用排饱和食盐水法收集少量氯气 |
| B、对2HI?H2+I2(g)平衡体系增加压强使颜色变深 |
| C、反应CO+NO2?CO2+NO 正反应放热,升高温度使平衡向正方向移动 |
| D、氢能是目前世界上比较理想的能源之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2溶于水发生了氧化还原反应 |
| B、Na2O2与CO2反应时,Na2O2只作氧化剂 |
| C、SO2使酸性KMnO4溶液褪色,体现了SO2的漂白性 |
| D、浓HNO3与C反应时,体现了HNO3的强氧化性和酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,NA个CO2分子的质量总和为44 g |
| B、常温常压下,1mol氦气含有的氦原子为1 NA |
| C、12.4 g 白磷(P4)中含有的磷原子数为0.4 NA |
| D、0.1 mol?L-1稀硫酸100 mL中含硫酸根个数为0.1 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com