
| A、Al3+、Na+、CO32-、NO3- |
| B、Ag+、Cl-、Fe3+、HCO3- |
| C、Fe2+、H+、K+、MnO4- |
| D、Mg2+、Br-、NH4+、SO42- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氯气的水溶液可以导电,说明氯气是电解质 |
| B、漂白粉和明矾都常用于自来水的处理,但二者的作用原理是不相同的 |
| C、氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 |
| D、为证明氯水中含Cl-,可先加盐酸酸化,再加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在常温下,Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,说明H2CO3酸性强于H2SiO3;在高温下,Na2CO3+SiO2=Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3 |
| B、胶体区别于其他分散系的本质特点是能产生丁达尔现象 |
| C、KAl(SO4)2?12H2O是复盐;(NH4)2Fe(SO4)2也是复盐 |
| D、CaCl2、NaOH、HCl、HD四种物质都属于化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)=c(OH-)=10-6 mol?L-1 溶液 |
| B、pH=7的溶液 |
| C、滴入酚酞呈无色的溶液 |
| D、酸与碱恰好完全反应生成正盐的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
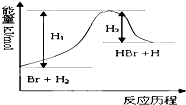 参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的( )
参照反应Br+H2→HBr+H的能量对反应历程的示意图,下列叙述中正确的( )| A、正反应为放热反应 |
| B、加入催化剂,该化学反应的反应热不改变 |
| C、加入催化剂,该化学反应的活化能不改变 |
| D、加入催化剂可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、因为Na2CO3+SiO2
| ||||
| B、碳和硅都是ⅣA族的元素,所以二氧化碳和二氧化硅的物理性质相似 | ||||
| C、二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物 | ||||
| D、二氧化硅和二氧化碳都是酸性氧化物,但二氧化硅不能和水反应生成硅酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO2的水解产物是Ca(OH)2和H2O2 |
| B、Mg3N2的水解产物是两种碱 |
| C、PCl3的水解产物是HClO和PH3 |
| D、CaC2的水解产物之一是C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胆矾是电解质、液氨是非电解质 |
| B、淀粉溶液、硅酸、氯化铁溶液均为胶体 |
| C、淀粉、纤维素、油脂都属于天然高分子化合物 |
| D、SO3、SiO2、NO2均为酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应属于氧化还原反应 |
| B、此反应中只有砷元素被氧化,只有氮元素被还原 |
| C、HNO3、H2O是反应物,H2SO4、NO、H3AsO4是生成物 |
| D、HNO3、H2SO4、H3AsO4都是最高价氧化物对应的水化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com