
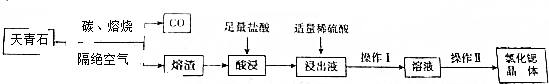
分析 以天青石(主要成分为SrSO4、杂质为BaSO4等物质)为原料制备六水氯化锶(SrCl2•6H2O),由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,SrS加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,所以过滤后滤渣为硫酸钡,滤液中含SrSO4、SrCl2,最后蒸发、冷却结晶得到SrCl2•6H2O,
(1)空气中的氧气在高温下能氧化碳,研磨粉碎的目的是增加反应物的接触面积,提高反应速率,提高原料的转化率;
(2)熔烧时SrSO4、被碳还原生成SrS,根据元素守恒和电子得失守恒可书写化学反应方程式;在熔烧时BaSO4等还原成BaS,酸浸时会与盐酸反应生成氯化钡和硫化氢等;
(3)浸出液中含有Sr2+、Ba2+、Cl-等,加入硫酸可以除去Ba2+,操作Ⅰ是分离固体和溶液的,操作Ⅱ是从氯化锶溶液中获得六水氯化锶晶体,可以将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得SrCl2•6H2O,当温度过高时晶体会失去结晶水,据此答题;
解答 解:以天青石(主要成分为SrSO4、杂质为BaSO4等物质)为原料制备六水氯化锶(SrCl2•6H2O),由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,SrS加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,所以过滤后滤渣为硫酸钡,滤液中含SrSO4、SrCl2,最后蒸发、冷却结晶得到SrCl2•6H2O,
(1)空气中的氧气在高温下能氧化碳,所以要隔绝空气,以防止氧气与碳反应,研磨粉碎的目的是增加反应物的接触面积,提高反应速率,提高原料的转化率,
故答案为:以防止氧气与碳反应;增加反应物的接触面积,提高反应速率,提高原料的转化率;
(2)熔烧时SrSO4、被碳还原生成SrS,化学反应方程式为SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑,在熔烧时BaSO4等还原成BaS,酸浸时会与盐酸反应生成氯化钡和硫化氢,反应的方程式为BaS+2HCl=BaCl2+H2S↑,
故答案为:SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑;BaS+2HCl=BaCl2+H2S↑;
(3)浸出液中含有Sr2+、Ba2+、Cl-等,加入硫酸可以除去Ba2+,操作Ⅰ是分离固体和溶液的,可以用过滤的方法,操作Ⅱ是从氯化锶溶液中获得六水氯化锶晶体,可以将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得SrCl2•6H2O,当温度过高时晶体会失去结晶水,温度过低干燥的速率又慢,所以用50-60℃,使晶体干燥且防止晶体失去结晶水,
故答案为:除去Ba2+;过滤;蒸发浓缩、冷却结晶、过滤、洗涤、干燥;使晶体干燥且防止晶体失去结晶水.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中发生的化学反应及物质分离方法为解答的关键,注意流程分析与所学知识的综合应用,综合性较强,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  | ||||
| E. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 铜片与浓HNO3:Cu+2NO3-+4H+═Cu2++NO2↑+2H2O | |
| C. | 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
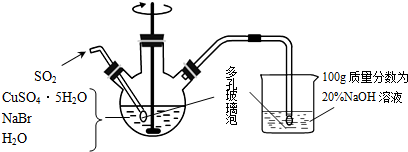
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
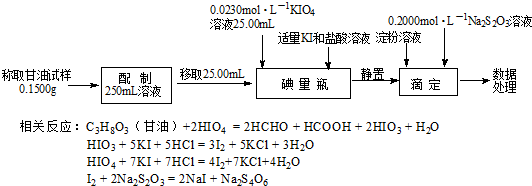
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com