

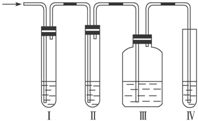
分析 (1)金属与浓硝酸反应会生成二氧化氮,要验证NO的生成,则先冷却使二氧化氮与NO分离,再与氧气反应,最后要加尾气处理装置;
(2)根据NO易被氧化来分析;
(3)根据装置D中的反应来分析现象;
(4)氧气过量,则4NO2+O2+2H2O=4HNO3;
(5)利用硝酸与金属的化学反应方程式及极限法来分析.
解答 解:(1)因属与浓硝酸反应会生成二氧化氮,要验证NO的生成,则先冷却使二氧化氮与NO分离,则选择E装置,验证NO的存在,利用其与氧气反应生成红棕色气体,则选择D装置,氮的氧化物对环境有污染,不能排放在环境中,应利用碱处理尾气,则选择F装置,所选择仪器的连接顺序为E→D→F,
故答案为:E→D→F;
(2)因NO易被氧化,若装置中存在氧气则不能说明NO的存在,所以反应前先通入N2目的是排尽装置中的空气,防止NO被氧化,故答案为:排尽装置中的空气,防止NO被氧化;
(3)因NO与氧气反应生成二氧化氮,则观察到D中烧瓶内通入O2后,无色气体变成红棕色,
故答案为:D中烧瓶内通入O2后,无色气体变成红棕色;
(4)因氧气过量发生4NO2+O2+2H2O=4HNO3,硝酸与碱反应生成硝酸钠,整个过程的化学反应为4NO2+O2+4NaOH=4NaNO3,
故答案为:4NO2+O2+4NaOH=4NaNO3;
(5)由M+4HNO3═M(NO3)2+NO2↑+2H2O,只生成二氧化氮时,被还原硝酸的物质的量n为$\frac{a}{2}$mol,
由3M+8HNO3═3M(NO3)2+2NO↑+4H2O,只生成一氧化氮,被还原硝酸的物质的量n为$\frac{a}{4}$mol,
以上两个反应都发生,则被还原硝酸的物质的量$\frac{a}{4}$mol<n<$\frac{a}{2}$mol,故答案为:$\frac{a}{4}$mol<n<$\frac{a}{2}$mol.
点评 本题考查金属与硝酸的反应,明确装置的作用、物质的性质、温度对化学平衡的影响、极限法分析等即可解答,难度稍大.


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
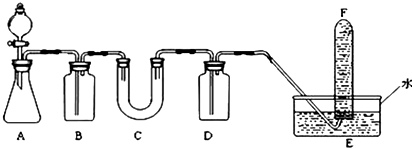
 (1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)
(1)在实验室里制取乙烯常因温度过高而使乙醇和浓H2SO4反应生成少量的SO2,有人设计如图所示实验以确认上述混和气体中有C2H4和SO2. (乙烯的制取装置略)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| B. | 氯化亚铁溶液和稀硝酸混合:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| C. | AlCl3溶液中加入足量的氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | NO2溶于水:3NO2+H2O═2H++2NO3-+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光纤的主要成分是高纯度的单质硅 | |
| B. | SiO2是酸性氧化物,它不溶于水也不溶于任何酸 | |
| C. | 因高温时SiO2与Na2CO3反应放出CO2,所以H2SiO3酸性比H2CO3强 | |
| D. | 28Si、29Si、30Si互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,所以
,所以查看答案和解析>>
科目:高中化学 来源: 题型:解答题
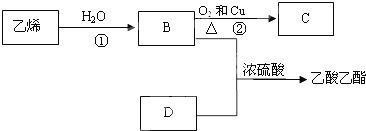

 反应类型:加聚反应.
反应类型:加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ①②③⑤⑦⑧ | D. | ①②⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
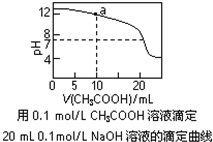
| A. | pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>① | |
| B. | 0.1mol•L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) | |
| C. | 图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) | |
| D. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com