
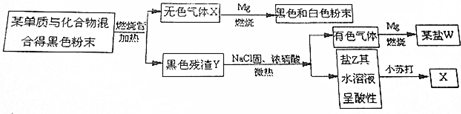
分析 根据题中各物质转化关系,镁能在无色气体X中燃烧得黑色和白色粉末,则X为CO2,黑色和白色粉末分别为碳和氧化镁,镁能在有色气体中燃烧生成某盐,则该有色气体为氯气,W为NaCl,盐Z能与碳酸氢钠反应生成二氧化碳,根据转化关系利用元素守恒可知,氯化钠固体与浓硫酸微热条件下可以生成氯化氢和NaHSO4,二氧化锰能与氯化氢反应生成氯气,所以Y为二氧化锰,则原两种黑色粉末中单质为碳,化合物为二氧化锰,据此答题;
解答 解:根据题中各物质转化关系,镁能在无色气体X中燃烧得黑色和白色粉末,则X为CO2,黑色和白色粉末分别为碳和氧化镁,镁能在有色气体中燃烧生成某盐,则该有色气体为氯气,W为NaCl,盐Z能与碳酸氢钠反应生成二氧化碳,根据转化关系利用元素守恒可知,氯化钠固体与浓硫酸微热条件下可以生成氯化氢和NaHSO4,二氧化锰能与氯化氢反应生成氯气,所以Y为二氧化锰,则原两种黑色粉末中单质为碳,化合物为二氧化锰,
(1)根据上面的分析可知,原两种黑色粉末的名称是碳和 二氧化锰,W盐的化学式为 NaCl,
故答案为:碳;二氧化锰;NaCl;
(2)CO2与Mg反应生成氧化镁和碳,反应的化学方程式为CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$C+2MgO,
故答案为:CO2+2Mg$\frac{\underline{\;点燃\;}}{\;}$C+2MgO;
(3)氯化钠固体与浓硫酸微热条件下可以生成Z含有NaHSO4,能电离出氢离子,所以溶液呈酸性,
故答案为:氯化钠固体与浓硫酸微热条件下可以生成Z含有NaHSO4,能电离出氢离子.
点评 本题考查无机物推断,涉及氯、镁等元素化合物性质与转化,难度不大,需要学生熟练掌握元素化合物知识,答题时注意基础知识的灵活运用.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 试回答下列问题:
试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2的燃烧热为285.8 kJ/mol,则H2O电解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.8 kJ/mol | |
| B. | 1 mol CH4完全燃烧生成CO2(g)和H2O(l)时放出890 kJ的热量,其热化学方程式为 $\frac{1}{2}$CH4(g)+O2(g)═$\frac{1}{2}$CO2(g)+H2O(l)△H=-445 kJ/mol | |
| C. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ/mol,则C的燃烧热为110.5 kJ/mol | |
| D. | HF与NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
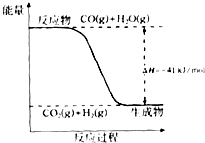 已知一氧化碳与水蒸气反应过程的能量变化如图所示:
已知一氧化碳与水蒸气反应过程的能量变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.
;ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,取代反应
,取代反应 ,取代反应
,取代反应查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com