
 2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.
2015年8月12号接近午夜时分,天津滨海新区一处集装箱码头发生爆炸.发生爆炸的是集装箱内的易燃易爆物品,爆炸火光震天,并产生巨大蘑菇云.分析 (1)同周期元素第一电离能自左而右呈增大趋势,同主族自上而下元素第一电离能逐渐减小,但N原子的2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;
(2)与水分子形成氢键,增大物质的溶解度;烧碱由钠离子和氢氧根构成,属于离子晶体;S2-离子核外电子数为18,根据能量最低原理可书写其基态电子排布式;
(3)NO3-离子中氮原子的孤电子对数=$\frac{5+1-2×3}{2}$=0,价层电子对数=3+0=3;
(4)原子总数相等、价电子总数也相等的微粒互为等电子体,CN-与N2互为等电子体,CN-中含有C≡N三键,三键中含有1个σ键、2个π键数;
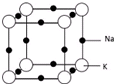
(5)根据均摊法计算晶胞中Na、K原子数目,确定合金的化学式,根据晶胞图可知,每个K 原子周围有6个钠原子;根据晶胞的结构可知,晶胞的边长为钠原子和钾原子的直径之和,晶体的空间利用率为$\frac{晶胞中Na、K原子总体积}{晶胞体积}$×100%.
解答 解:(1)同周期元素第一电离能自左而右呈增大趋势,同主族自上而下元素第一电离能逐渐减小,但N原子的2p能级为半满稳定状态,最难失去电子,第一电离能高于氧元素的,故NH4NO3、NaCN两种物质的元素中第一电离能最大的是N,
故答案为:N;N的2p轨道半充满,最难失去电子;
(2)甲酸与水形成氢键,而二甲基二硫不能,故二甲基二硫和甲酸中溶解度较大的是甲酸,烧碱由钠离子和氢氧根构成,所以烧碱是离子晶体,S2-离子核外有18个电子,其基态电子排布式为1s22s22p63s23p6,
故答案为:甲酸;离子晶体;1s22s22p63s23p6;
(3)NO3-离子中氮原子的孤电子对数=$\frac{5+1-2×3}{2}$=0,价层电子对数=3+0=3,所以NO3-立体构型为平面三角形,中心原子氮原子的杂化轨道类型sp2,
故答案为:平面三角形;sp2;
(4)原子序数相等、价电子总数也相等的微粒互为电子,CN-与N2互为等电子体,二者结构相似,CN-中含有C≡N三键,三键中含有1个σ键、2个π键数,所以1mol化合物NaCN中CN-所含的π键数为2NA,CN-中含有两个原子、10个价电子,与CN-互为等电子体的分子有CO、N2,
故答案为:2NA;CO、N2;
(5)晶胞中,钠原子数为12×$\frac{1}{4}$=3,钾原子数为8×$\frac{1}{8}$=1,所以合金的化学式为KNa3,
根据晶胞图可知,每个K 原子周围有6个钠原子,所以晶胞中K 原子的配位数为6,
晶胞中钠原子和钾原子体积之和为$\frac{4}{3}$π[(186pm)3×3+(227pm)3],晶胞的边长为钠原子和钾原子的直径之和为2×(186pm+227pm),所以晶胞的体积为(2×186pm+2×227pm)3,晶体的空间利用率为
{$\frac{4}{3}$π[(186pm)3×3+(227pm)3]÷(2×186pm+2×227pm)3}×100%=$\frac{\frac{4}{3}π(18{6}^{3}×3+22{7}^{3})}{(186×2+227×2)^{3}}$×100%,
故答案为:KNa3;6;$\frac{\frac{4}{3}π(18{6}^{3}×3+22{7}^{3})}{(186×2+227×2)^{3}}$×100%.
点评 本题是对物质结构与性质的考查,涉及电离能、核外电子排布、杂化方式与空间构型、等电子体、晶胞计算等,难度中等,侧重于学生的分析能力和计算能力的考查,注意基础知识的理解掌握.


科目:高中化学 来源:2017届江苏省如皋市高三上学期质量调研一化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
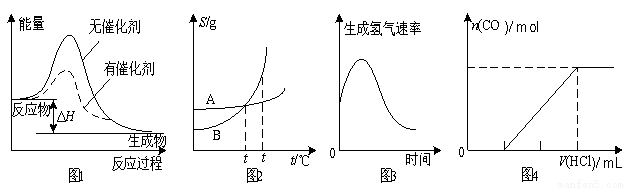
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
D.图4表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1 mol·L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的氯化铁溶液中:Na+、K+、Br-、SCN- | |
| B. | 水电离出的氢氧根离子浓度为10-13mol/L的溶液中:NH4+、K+、SiO32-、SO42? | |
| C. | 使酚酞试液变红色的溶液中:Na+、K+、HCO3-、S2? | |
| D. | 澄清透明的溶液中:K+、Ca2+、MnO4-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
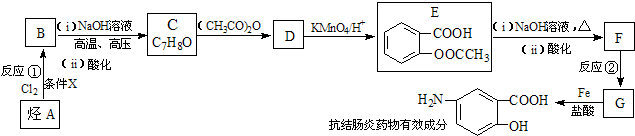
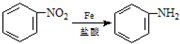
 ;
;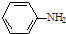 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸( 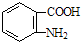 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)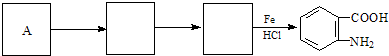
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
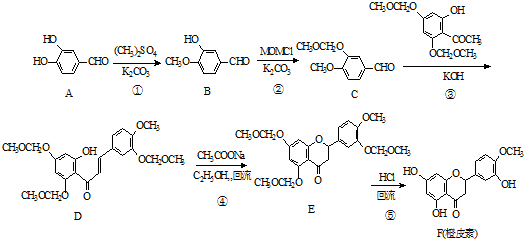
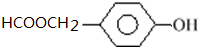 .
. 和CH3CHO为原料制备化合物
和CH3CHO为原料制备化合物 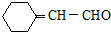 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com