
| A、1mol氯气参加氧化还原反应,转移的电子数一定为2NA | B、25℃时,1L pH=12的Na2CO3溶液中含有Na+的数目为0.02NA | C、12g石墨和C60的混合物中质子总数一定为6NA个 | D、常温常压下,22.4L乙烯中C-H键数为4NA |


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
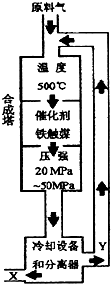 合成氨反应(N2+3H2?2NH3+92.4KJ)在化学工业和国防工业具有重要意义.工业合成氨生产示意图如图所示.
合成氨反应(N2+3H2?2NH3+92.4KJ)在化学工业和国防工业具有重要意义.工业合成氨生产示意图如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下,11.2L乙烷中含有共价键的数目为3NA | B、标况下,22.4L O2和CO2组成的混合物中含有氧原子数为2NA | C、常温下,22.4L甲烷中含有的电子数为10NA | D、常温下,1L 0.1mol?L-1的Na2CO3溶液中含OH-离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=13的氨水中含有OH-的数目为0.1NA | B、1mol Na被完全氧化生成Na2O2,转移电子的数目为NA | C、标准状况下,2.24L NO2与水反应生成NO3-的数目为0.1NA | D、4.0g H2与足量N2完全反应生成NH3,反应中断裂共价键的总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L CH4和CH3CH2OH的混合物所含分子数为NA | B、常温常压下,16g 14CH4所含中子数目为8NA | C、含0.2NA个阴离子的Na2O2和水完全反应转移0.2mol电子 | D、0.1L 3mol?L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、氯元素的相对原子质量是
| ||
B、m g该氯原子的物质的量是
| ||
| C、该氯原子的摩尔质量是a NA g/mol | ||
| D、a g该氯原子所含质子数是17NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,30g的2-丙醇中含有羟基的数目为0.5NA | B、标准状况下,11.2L乙炔中含有共用电子对的数目为1.5NA | C、1 mol?L-1的碳酸钠溶液中含有CO32-的数目小于NA | D、常温下,1mol O2和O3的混合气体中含有氧原子的数目为2.5NA |
查看答案和解析>>
科目:高中化学 来源:2014~2015学年重庆市9月月考高一化学试卷(解析版) 题型:实验题
(14分)某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 的硫酸溶液进行中和热的测定。
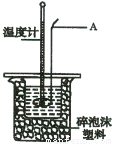 Ⅰ.配制0.50mol·L- 1 硫酸溶液
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为98%的浓硫酸 mL。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1) ;
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c= 4.18 J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。
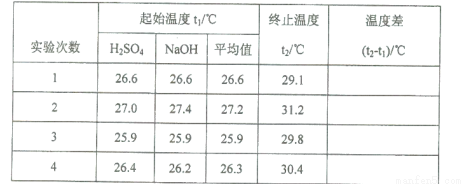
③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com