
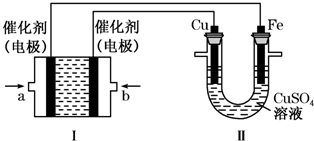
 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:分析 (1)CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=260kJ•mol-1①
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②,
将方程式2①+②得 2CH4(g)+O2(g)═2CO(g)+4H2(g),根据盖斯定律书写热化学反应方程式;
(2)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂;甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据I中氢氧根离子浓度变化确定溶液pH变化;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量;
③原电池中阳离子移向正极,阴离子移向负极,根据电极反应式进行计算即可.
(3)n(NaOH)=0.3mol,n(CO2)=0.2mol,二者发生CO2+3OH-=HCO3-+CO32-+H2O,生成等物质的量的NaHCO3和Na2CO3,溶液水解呈碱性,且水解程度CO32->HCO3-,结合结合CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,以及电荷守恒、物料守恒解答该题.
解答 解:(1)CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=260kJ•mol-1①
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②,
将方程式2①+②得 2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ;
(2)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以a处通入的气体是甲烷;甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4;CH4+10OH--8e-=CO32-+7H2O;
②根据I中电池反应为CH4+2O2+2KOH=K2CO3+3H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;
II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变,
故答案为:变小;不变;
③原电池中阳离子移向正极,H+移向b电极,阴离子移向负极,a处是负极,电极上发生失电子的氧化反应,该电极上发生的电极反应式为CH4-8e-+2H2O═CO2+8H+,故答案为:b;CH4-8e-+2H2O═CO2+8H+;
(3)n(NaOH)=0.3mol,n(CO2)=0.2mol,二者发生CO2+3OH-=HCO3-+CO32-+H2O,生成等物质的量的NaHCO3和Na2CO3,溶液水解呈碱性,且水解程度CO32->HCO3-,结合结合CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,
A.溶液呈电中性,溶液中阴阳离子所带电荷相等,所以c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故A错误;
B.n(CO32-)+n(HCO3-)+n(H2CO3)=0.2mol,n(Na+)=0.3mol,根据物料守恒得,2C(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)],故B正确;
C.n(CO32-)+n(HCO3-)+n(H2CO3)=0.2mol,n(Na+)=0.3mol,又存在①CO32-+H2O?HCO3-+OH-,②HCO3-+H2O?H2CO3+OH-,水解程度①>②且水解程度都较小,则c(HCO3-)>c(CO32-)>c(OH-),则有c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C正确;
D.根据阴阳离子所带电荷相等得c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)①,根据物料守恒得2c(Na+)=3[c(H2CO3)+c(HCO3-)+c(CO32-)]②,将方程式②-①×2得2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+),故D正确.
故选BCD.
点评 本题考查了盖斯定律、原电池和电解池原理,根据电解池中Cu、Fe电极上发生的反应确定燃料电池中正负极及电极上通入的气体,再结合转移电子相等计算,难点是电极反应式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 纯净的铁是光亮的银白色金属 | |
| B. | 铁能被磁铁吸引,在磁场作用下,铁自身也能产生磁性 | |
| C. | 铁是地壳中含量最多的金属元素,所以分布在地壳的铁有游离态也有化合态 | |
| D. | 纯铁的抗蚀能力相当强,在干燥的空气里不易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
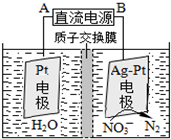 氮氧化合物是大气污染的重要因素.
氮氧化合物是大气污染的重要因素.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
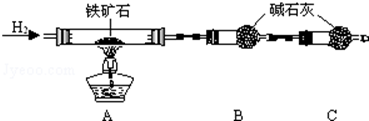
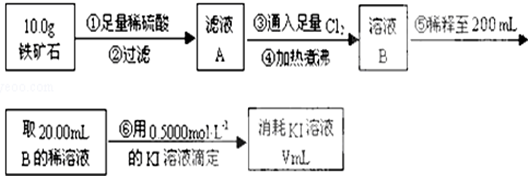
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时阳极反应为Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 充电时OH-向阳极移动 | |
| C. | 放电时每转移3mole-正极有1molK2FeO4被氧化 | |
| D. | 充电时,电源的正极应与电池的Zn(OH)2极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
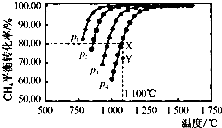
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
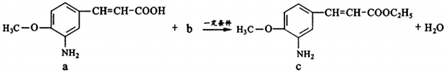
| A. | a中参加反应的官能团是羧基 | B. | 生活中b可作燃料和溶剂 | ||
| C. | c极易溶于水 | D. | 该反应类型为取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com