
(2)硅的化学性质不活泼,常温下除能与______________反应外,一般不与其他物质反应,加热在高温条件下能与______________等反应;从硅的氧化物中提取硅分为两步:①粗硅的制取:____________________,②粗硅转变为纯硅(常用的方法)___________________________,____________________________。
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:阅读理解
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ?mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
4- 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
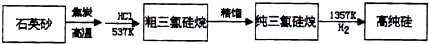
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光导纤维在信息产业中有广泛应用,制造光导纤维的主要材料是单质硅 | B、向煤中加入适量CaO可大大减少燃烧产物中SO2的量 | C、即将到来的新能源时代,核能、太阳能和氢能等很可能成为主要能源 | D、“嫦娥二号”于2010年10月1日成功“奔月”,在制造过程中使用了大量的复合材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com