
【题目】下表是元素周期表的一部分,对于表中元素①~⑧,填空回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)地壳中含量最多的元素是______,非金属性最强的元素是______。
(2)写出①的最简单的气态氢化物的电子式______。
(3)在第三周期主族元素中,单质氧化性最强的是_____,能形成的二元强酸是________。
(4)写出②的气态氢化物与②的最高价氧化物对应水化物反应的化学方程式_____。
【答案】O F 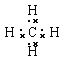 Cl2 H2SO4 NH3+HNO3=NH4NO3
Cl2 H2SO4 NH3+HNO3=NH4NO3
【解析】
由元素在周期表的位置可知,元素①~⑧分别为C、N、O、F、Na、Al、S、Cl,然后结合元素的性质与原子结构的知识分析解答。
由元素在周期表的位置可知,元素①~⑧分别为C、N、O、F、Na、Al、S、Cl。
(1)地壳中含量最高的元素为O,非金属性最强的元素为F;
(2)①的最简单的气态氢化物为甲烷,分子中C原子与4个H原子形成四对共用电子对,其电子式为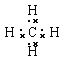 ;
;
(3)第三周期主族元素中Cl的非金属性最强,单质氧化性最强的是Cl2,S对应的硫酸为二元强酸,能形成的二元强酸是H2SO4;
(4)②的气态氢化物为NH3,②的最高价氧化物对应水化物为HNO3,二者反应生成NH4NO3,反应方程式为NH3+HNO3=NH4NO3。


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是一种重要的化工产品。它不溶于H2SO4、HNO3 和醇,微溶于水,可溶于浓盐酸和氨水,在潮湿空气中易水解氧化成绿色的碱式氯化铜[Cu2(OH)4-nCln],n随着环境酸度的改变而改变。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如图:
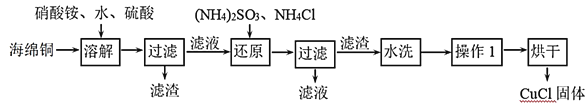
(1)还原过程中主要反应的离子方程式为_______。
(2)实验室为了加快过滤速度,往往采用抽滤的操作(如图)。仪器A的名称__________,有关抽滤,下列说法正确的是__________
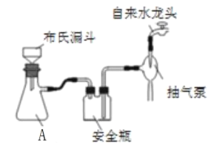
A.抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶上口倒出
B.在布氏漏斗中放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤
C.在抽滤装置中洗涤晶体时,为减少晶体溶解损失,应使洗涤剂快速通过滤纸
D.减压过滤不宜用于过滤胶状或颗粒太小的沉淀
(3)操作1为马上再洗涤,然后在真空干燥机内于70℃干燥2h,冷却、密封包装。其中最合理的洗涤试剂__________
A. 浓盐酸 B. 浓氨水 C. 无水乙醇 D. 水+乙醇
真空干燥的原因是___________。
(4)随着pH减小,Cu2(OH)4-nCln中铜的质量分数__________
A. 增大 B. 不变 C. 减小 D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
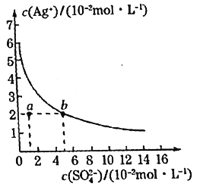
A.含有大量SO42-的溶液中肯定不存在Ag+
B.该温度下,Ag2SO4的溶度积常数(Ksp)的数量级是3
C.可以通过改变温度或加入硫酸银固体使a点移动到b点
D.该温度下,0.02mol·L-1的AgNO3溶液与0.2mol·L-1的Na2SO4溶液等体积混合,不会生成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置,可以在室温和一个标准大气压条件下测定镁的相对原子质量,Y型管中一侧放镁,一侧放稀硫酸,倾斜Y型管,将稀硫酸全部倒入另一侧,反应开始。
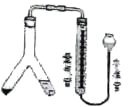
(1)在Y型管中添加试剂时,要确保________过量。
(2)反应前后都要调整量气管和水准管液面相平,从而保证_____相等。若读数时,量气管中的液面低于水准管的液面,实验测得H2的体积将______。(填“偏大”“偏小”或“不变”)
(3)若镁的质量为m g,c mol/L硫酸溶液V mL,反应后收集到的氢气体积为a mL(已折算为标准状况下),则镁的相对原子质量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置关系如图所示,已知X最外层电子数为2,则下列叙述中正确的是( )
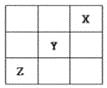
A.Z一定是活泼的金属元素
B.Y的最高价氧化物的水化物是一种强酸
C.1molX的单质跟足量水反应时,发生转移的电子为2mol
D.Y的氢化物稳定性大于Z的氢化物稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化氢常用于制备碘的化合物和用作有机反应的还原剂。碘化氢不稳定,易分解,碘化氢极易溶于水,其水溶液称为氢碘酸,氢碘酸是强酸,有较强的还原性。
(1)氢碘酸若在空气中长期放置,溶液会变成黄色,其原因是___(用化学方程式来表示)。
(2)实验室中常用干燥的红磷和碘相互接触,加少量水微热,即可生成碘化氢和亚磷酸(H3PO3),该反应的化学方程式为___。
(3)氢气和碘蒸气能直接反应生成碘化氢,H2(g)+I2(g)![]() 2HI(g) ΔH<0。T℃时,向1L恒容密闭容器中充入0.2molH2和0.2molI2(g),5min时反应达到平衡,H2、I2(g)和HI的物质的量浓度(c)随时间(t)变化的曲线如图l所示:
2HI(g) ΔH<0。T℃时,向1L恒容密闭容器中充入0.2molH2和0.2molI2(g),5min时反应达到平衡,H2、I2(g)和HI的物质的量浓度(c)随时间(t)变化的曲线如图l所示:
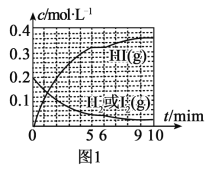
①0~5min内,以HI表示的该反应速率v(HI)=___。
②T℃时,该反应的平衡常数K=___。
③6min时,改变的外界条件为___。
④10min时,保持其他条件不变,再向容器中充入0.1molH2、0.1molI2(g)、0.2molHI(g),12min时达到新平衡。在图2中画出10~12min,H2和HI的浓度变化曲线___(曲线上标明H2和HI);0~5min和0~2min时间段,H2的转化率分别用α1、α2表示,则αl___α2(填“>”、“<”或“=”)。
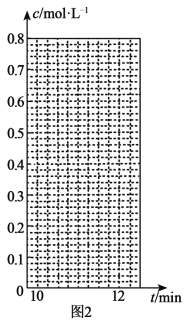
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D、E均为化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )

A. 若A是铁,则E可能为稀硝酸
B. 若A是CuO,E是碳,则B为CO
C. 若A是NaOH溶液,E是CO2,则B为NaHCO3
D. 若A是AlCl3溶液,E可能是氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月中国药学家屠呦呦因发现青蒿素(一种用于治疗疟疾的药物)而获得诺贝尔生理医学奖。青蒿素(C15H22O5)的结构如图所示。请回答下列问题:
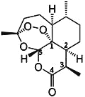
(1)组成青蒿素的三种元素电负性由小到大排序是_____,在基态O原子中,核外存在_____对自旋相反的电子。
(2)下列关于青蒿素的说法正确的是_____(填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均采取sp3杂化
c.图中数字标识的五个碳原子均只以σ键与其它原子成键
(3)在确定青蒿素结构的过程中,可采用NaBH4作为还原剂,其制备方法为:4NaH+B(OCH3)→3NaBH4+3CH3ONa
①NaH为_____晶体,如图是NaH晶胞结构,则NaH晶体的配位数是_____,若晶胞棱长为a,则Na原子最小核间距为_____。
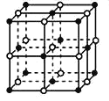
②B(OCH3)3中B采用的杂化类型是_____。写出两个与B(OCH3)3具有相同空间构型的分子或离子_____。
③NaBH4结构如图所示,结构中存在的化学键类型有_____。
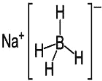
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com