
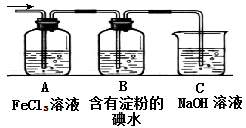
 2Na+Cl2↑(4)SO2+2Fe3++2H2O=SO42-+Fe2++4H+ SO2+I2+2H2O=4H++2I-+SO42-(5)c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO)
2Na+Cl2↑(4)SO2+2Fe3++2H2O=SO42-+Fe2++4H+ SO2+I2+2H2O=4H++2I-+SO42-(5)c(Na+)+c(H+)=c(OH-)+c(HSO)+2c(SO) 2Na+Cl2↑。
2Na+Cl2↑。

科目:高中化学 来源:不详 题型:实验题
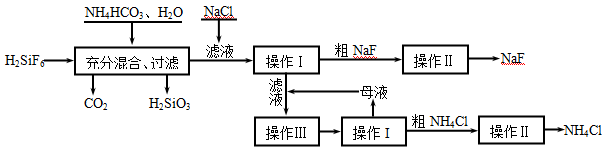
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
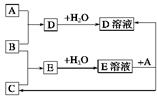
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
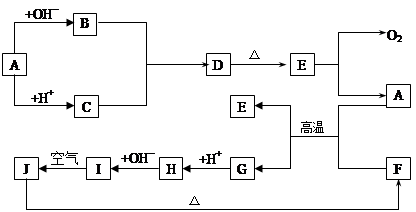
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
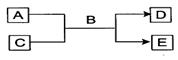
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
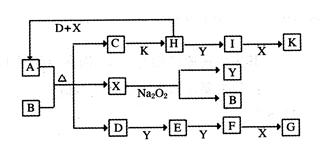
 cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
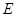 可以发生反应:2E+I
可以发生反应:2E+I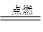 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.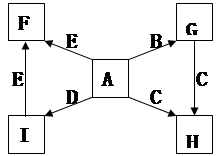
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
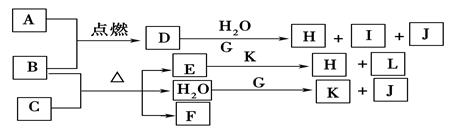
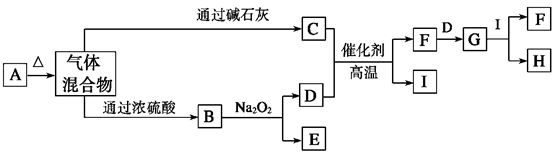 (1)A、F的化学式分别为 、 。?
(1)A、F的化学式分别为 、 。?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com