
分析 RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,R元素化合价由+$\frac{6}{x}$价升高到+4价,Mn元素化合价由+7价降低到+2价,结合氧化还原反应中氧化剂和还原剂之间得失电子数目相等解答该题.
解答 解:(1)R元素化合价由+$\frac{6}{x}$价升高到+4价,0.2molRxO42- 参加反应,共转移0.4mol 电子,则0.2mol×x×(4-$\frac{6}{x}$)=0.4mol,x=2,
故答案为:2;
(2)根据电子守恒配平后的化学方程式为:5R2O42-+2MnO4-+16H+=10RO2+2Mn2++8H2O,当消耗5molR2O42-时,需要氢离子的物质的量是16mol,所以0.2 mol R2O42-参加反应时,反应的H+的物质的量为0.64mol,故答案为:0.64 mol.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力和计算能力的考查,注意元素化合价的判断,为解答该题的关键,从元素化合价的角度解答该类题目,难度不大.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题
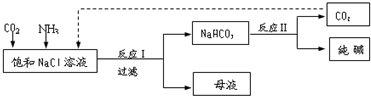
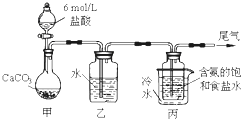
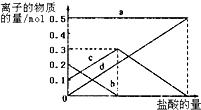
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
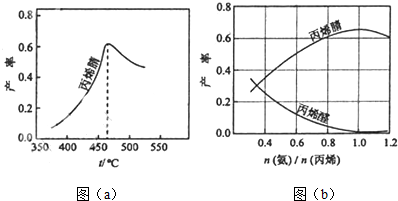
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用高效催化剂 | B. | 充入更多N2 | C. | 降低温度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.
研究和开发CO2 和CO的创新利用是环境保护和资源利用的双赢的课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(HCO3-)=0.1mol/L的溶液中:NH4+、Al3+、Cl-、NO3- | |
| B. | 室温下,PH=2的溶液中:Fe2+、SO42-、Na+、NO3- | |
| C. | 无色透明的溶液中:NH4+、Cl-、NO3-、Fe3+ | |
| D. | 使红色石蕊试纸变蓝的溶液中:SO32-、Na+、CO32-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com