
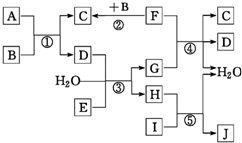
 下列转化关系图中,A、B、C、D、E在常温下为气体,B、E、F为单质,其中F为黑色固体;C、D均能使澄清的石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物;反应④中固态F与G的浓溶液在加热时方能发生反应.回答下列问题:
下列转化关系图中,A、B、C、D、E在常温下为气体,B、E、F为单质,其中F为黑色固体;C、D均能使澄清的石灰水变浑浊,D、E均能使品红溶液褪色;I是一种红棕色固体氧化物;反应④中固态F与G的浓溶液在加热时方能发生反应.回答下列问题:分析 A、B、C、D、E在常温下为气体,C、D均能使澄清的石灰水变浑浊,分别为SO2、CO2中的一种,D、E均能使品红溶液褪色,分别为SO2、Cl2中的一种,E为单质,则E为Cl2,D为SO2,C为SO2.气体A与气体单质B反应得到二氧化碳、二氧化硫,则B为O2,则A中至少含有C、S两种元素,由(5)中A的密度为2.68g/L,可知Mr(A)=2.68×22.4=60,可推知A为COS;F为黑色固体,与氧气反应生成二氧化碳,故F为碳;D与E、水反应生成硫酸与HCl,而碳与G反应得到二氧化碳、二氧化硫,则G为H2SO4,H为HCl;I是一种红棕色固体氧化物,则I为Fe2O3,与H反应生成J为FeCl3,据此解答.
解答 解:A、B、C、D、E在常温下为气体,C、D均能使澄清的石灰水变浑浊,分别为SO2、CO2中的一种,D、E均能使品红溶液褪色,分别为SO2、Cl2中的一种,E为单质,则E为Cl2,D为SO2,C为SO2.气体A与气体单质B反应得到二氧化碳、二氧化硫,则B为O2,则A中至少含有C、S两种元素,由(5)中A的密度为2.68g/L,可知Mr(A)=2.68×22.4=60,可推知A为COS;F为黑色固体,与氧气反应生成二氧化碳,故F为碳;D与E、水反应生成硫酸与HCl,而碳与G反应得到二氧化碳、二氧化硫,则G为H2SO4,H为HCl;I是一种红棕色固体氧化物,则I为Fe2O3,与H反应生成J为FeCl3,
(1)I是一种红棕色粉末,I为Fe2O3,俗称铁红,常用于制造红色油漆和涂料;C为SO2,分子中的化学键类型为:共价键,
故答案为:铁红;共价键;
(2)测得室温下FeCl3溶液的pH=2.0,溶液中氢离子源于水的电离,则由水电离产生的c(H+)=0.01mol•L-1,
故答案为:0.01;
(3)反应③的离子方程式为:SO2+Cl2+2H2O═4H++2Cl-+SO42-,
故答案为:SO2+Cl2+2H2O═4H++2Cl-+SO42-;
(4)反应④的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O;
(5)由上述分析可知,A的化学式为COS,故答案为:COS.
点评 本题考查无机物推断,物质的颜色、特殊性质等是推断突破口,需要学生熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:选择题
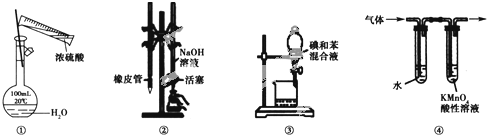
| A. | 图①所示装置进行浓硫酸稀释配制稀硫酸的实验 | |
| B. | 图②所示装置进行用已知浓度为NaOH溶液测定盐酸浓度的实验 | |
| C. | 图③所示装置进行用苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗下口倒出 | |
| D. | 图④所示装置可检验溴乙烷发生消去反应得到的气体中含有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=l的溶液中:Ca2+、Fe2+、NO3- | |
| B. | $\frac{Kw}{c(O{H}^{-})}$=10-2的溶液中:Na+、NH4+、Cl- | |
| C. | c(Fe3+)=0.1 mol.L-1的溶液中:K+、SCN-、SO42- | |
| D. | 由水电离的c(H+)=1×10-14 mol.L-1的溶液中:Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )
右图所示的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质).下列分析不正确的是( )| A. | 电子由Ag电极经外电路流向Pt电极 | |
| B. | 空气中c(Cl2)越大,Ag极消耗速率越快 | |
| C. | 正极反应:Cl2+2e-+2Ag+═2AgCl | |
| D. | 原电池工作时电解质中Ag+数目减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞变红色的溶液:NH4+、Ca2+、NO3-、SO42- | |
| B. | c(OH-)=1×10-13 mol•L-1的溶液:Na+、K+、ClO-、SO42- | |
| C. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| D. | 0.1 mol•L-1 KMnO4溶液:Na+、Mg2+、NO3-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn.
X、Y、Z、M为前四周期中除氢以外原子序数依次增大的四种元素,X基态原子未成对电子数在所处周期中最多;Y元素原子核外共有3个能级,且最高能级电子数是前两个能级电子数之和;Z的单质常温下为淡黄色固体,ZY3分子呈平面正三角形;M原子外围电子排布式为3dn4sn.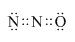 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4(熔融)═Na++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | CH3COOH?CH3COO-+H+ | D. | H2CO3?2H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com