
A、异丁烷的结构式: |
B、Li原子的轨道表示式: |
C、二氧化碳的电子式: |
| D、饱和醇的通式:CnH2n+2O |
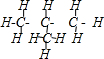 ,故A错误;
,故A错误; ,故B正确;
,故B正确;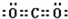 ,故C错误;
,故C错误;

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
 用右图表示的一些物质或概念之间的从属或包含关系中不正确的是( )
用右图表示的一些物质或概念之间的从属或包含关系中不正确的是( )| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 苯 | 芳香烃 | 有机化合物 |
| B | 溶液 | 分散系 | 混合物 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| H2SO4 |
| CuO |
| H2SO4 |
| Fe |
| A、①方案多 | B、②方案多 |
| C、一样多 | D、不确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:
| 金属离子 | pH值 | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Zn2+ | 7.6 | 8.3 |
| Cu2+ | 5.8 | 7.5 |
| Al3+ | 4.0 | 5.4 |
| Fe3+ | 2.7 | 3.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气跟水反应:Cl2+H2O→2H++Cl-+ClO- |
| B、硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓ |
| C、次氯酸钠溶液中通入CO2:ClO-+CO2+H2O→HCO3-+HClO |
| D、碳酸钙中加入醋酸:CO32-+2CH3COOH→CO2↑+2CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气用于自来水消毒:Cl2+H20═HCl+HCl0 | ||||
B、用催化法处理汽车尾气中的C0和N0:CO+N0
| ||||
| C、NaOH溶液不能保存在玻璃塞的试剂瓶中:Si02+20H-═Si032-+H2O | ||||
D、红热的铁丝与承接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H20
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/℃ | 30 | 40 | 50 |
| NH3的平衡浓度/(×10-6mol/L) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com