
【题目】绿色化学对化学反应提出了“原子经济性”(原子节约)的新概念及要求。理想的“原子经济性”反应是原料分子中的原子全部转变成所需产物,不产生副产物,实现零排放。以下反应中符合绿色化学原理的是
A.乙烯与氧气在银催化作用下生成环氧乙烷(![]() )
)
B.乙烷与氯气制备氯乙烷
C.苯和乙醇为原料,在一定条件下生产乙苯
D.乙醇与浓硫酸共热制备乙烯
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g) ![]() 4NO2(g)+ O2(g),反应吸热。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
4NO2(g)+ O2(g),反应吸热。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是( )
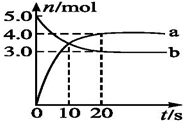
A.10min时,反应达到平衡
B.曲线a表示NO2的物质的量随反应时间的变化
C.0~20min内平均反应速率v(N2O5)=0.1molL-1min-1
D.达到平衡时,N2O5的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氯水和二氧化硫都具有漂白作用,两者漂白原理相同
B.等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等
途径a:![]() ;途径b:
;途径b:![]()
C.1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为1.5NA
D.从海水中提取物质都必须通过化学反应才能实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿是工业上制取铝的基本原料。为了除去铝土矿中少量Fe2O3和SiO2等杂质制得纯净的Al2O3,某化学兴趣小组设计探究实验,操作过程如图所示:

(1)操作过程中的试剂或方法:A是 ,B是 ,C是 。
(2)在溶液乙中通入过量CO2后发生反应的离子方程式为
(3)如果A、B互换,则通CO2应改加 。
(4)如果A、B互换,将溶液乙蒸干并灼烧,所得固体产物的主要成分是 (写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是
A.二氧化硫可广泛用于食品的增白
B.硫酸钡可用作钡餐透视
C.聚乙烯塑料制品可用于食品的包装
D.次氯酸钠溶液可用于环境的消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:
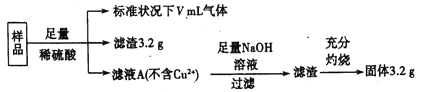
下列说法正确的是( )
A.滤液A中的阳离子为Fe3+、Fe2+、H+ B.样品中Fe元素的质量为2.24g
C.样品中CuO的质量为4.0g D.V=896
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用天然气热裂解制取乙炔和氢气近年来成为各国研究的热点,发生的主要反应为:2CH4(g)![]() C2H2(g)+3H2(g) △H=a kJmol-1,副反应:2CH4(g)
C2H2(g)+3H2(g) △H=a kJmol-1,副反应:2CH4(g)![]() C2H4(g)+2H2(g) 回答下列问题:
C2H4(g)+2H2(g) 回答下列问题:
(1)天然气热裂解过程使用的催化剂中含有SiO2、Al2O3等多种难被还原的氧化物,写出SiO2的另外两种用途:_______________________,写出Al2O3与苛性钾溶液反应的离子方程式___________________;
(2)已知甲烷的燃烧热△H=-890.3kJmol-1,乙炔的燃烧热△H=-1299.6kJmol-1,氢气的燃烧热△H=-285.8kJmol-1,则上式中的a=___________;
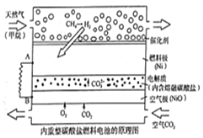
(3)天然气经重整催化作用生成氢气,氢气在下图所示的燃料电池中放电(以熔融Li2CO3和K2CO3为电解质),写出燃料极上发生的电极反应式_______________________________;
(4)某温度下,向1L恒容密闭容器中充入0.3mol甲烷,控制条件使其只发生上述副反应,达到平衡时,测得c(C2H4)=c(CH4),则该条件下甲烷的平衡转化率为__________;
(5)天然气裂解过程中,平衡时各气体分压(单位为Pa)的对数(δ)与温度(T)之间的关系如下图:

①副反应2CH4(g)![]() C2H4(g)+2H2(g) 的△H__________(填“>”或“<”)0;
C2H4(g)+2H2(g) 的△H__________(填“>”或“<”)0;
②利用图中数据计算A点温度下主要反应2CH4(g)![]() C2H2(g)+3H2(g)的平衡常数__________(利用平衡分压代替平衡浓度计算,
C2H2(g)+3H2(g)的平衡常数__________(利用平衡分压代替平衡浓度计算,![]() )。
)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com