
| A. | 在化学键的断裂过程中,肯定发生了化学反应 | |
| B. | 发生能量变化的一定是化学反应 | |
| C. | 离子化合物中一定含有离子键,共价化合物中一定不含离子键 | |
| D. | 在化学键的断裂过程中,肯定放出能量 |
分析 A.只有有化学键断裂和化学键形成的过程才发生化学反应;
B.物理变化时也可能发生能量变化;
C.含有离子键的化合物属于离子化合物,只含有共价键的化合物属于共价化合物;
D.化学键的断裂过程中,肯定吸收能量.
解答 解:A.只有有化学键断裂和化学键形成的过程才发生化学反应,有化学键断裂的过程不一定发生化学反应,如电解质溶于水的过程,故A错误;
B.物理变化时也可能发生能量变化,如气态水液化会放出热量,所以伴有能量变化的物质变化不一定是化学变化,故B错误;
C.含有离子键的化合物属于离子化合物,离子化合物中可能含有共价键,只含有共价键的化合物属于共价化合物,共价化合物中一定不含有离子键,故C正确;
D.化学键的断裂过程中,肯定吸收能量,形成肯定放出能量,故D错误;
故选C.
点评 本题考查了化学键的有关知识,明确化学键的概念及化学反应的实质是解本题关键,难度不大,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 浓解度:碳酸氢钠>碳酸钠 | |
| B. | 热稳定性:碳酸钠<碳酸氢钠 | |
| C. | 等质量时与足量酸反应产气量:碳酸钠>碳酸氢钠 | |
| D. | 一定的条件下可以相互转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )
一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应:N2(g)+O2(g)?2NO(g),曲线a表示该反应在温度T℃时N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.叙述正确的是( )| A. | 温度T℃时,该反应的平衡常数K=$\frac{4({c}_{0}-{c}_{1})^{2}}{{c}_{{T}^{2}}}$ | |
| B. | 温度T℃时,混合气体的密度不变即达到平衡状态 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 若曲线b改变的条件是温度,则该正反应放热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
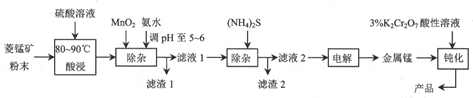
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①⑤⑥ | C. | ②④⑥ | D. | ⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2→NO→NO2 | B. | Fe→FeCl2→Fe (OH)2 | C. | S→SO3→H2SO4 | D. | Na→Na2O2→NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期元素的正化合价由+1→+7依次升高 | |
| B. | PH3在空气中可以自燃,根据元素周期律可以推知SiH4很难燃烧 | |
| C. | Cl的非金属性强于S,所以HClO3的酸性一定强于H2SO3 | |
| D. | Li的电子层数小于Al,但是Li的原子半径却却大于Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ②③④⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com