
| 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 | 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 | 共价键 | 断开该键吸收的能量或生成该键放出的能量/kJ•mol-1 |
| H-H | 436 | H-Br | 366 | Cl-Cl | 243 |
| H-O | 463 | H-I | 298 | Br-Br | 193 |
| H-Cl | 432 | O=O | 496 | I-I | 151 |
| A. | ①④ | B. | ②③ | C. | 只有① | D. | 只有④ |
分析 根据反应的反应热△H=断键吸收的能量-成键放出的能量,若△H<0,则反应放热,若△H>0,则反应吸热,据此分析.
解答 解:①2H2O(g)═2H2(g)+O2(g)△H=断键吸收的能量-成键放出的能量=4×463KJ/mol-2×436KJ/mol-496KJ/mol=+484KJ/mol>0,故反应吸热;
②H2(g)+Cl2(g)═2HCl(g)△H=断键吸收的能量-成键放出的能量=436KJ/mol+243KJ/mol-2×432KJ/mol=-185KJ/mol<0,反应放热;
③H2(g)+Br2(g)═2HBr(g)△H=断键吸收的能量-成键放出的能量=436KJ/mol+193KJ/mol-2×366KJ/mol=-103KJ/mol<0,反应放热;
④2HI(g)═H2(g)+I2(g)△H=断键吸收的能量-成键放出的能量=2×298KJ/mol-436KJ/mol-151KJ/mol=+9KJ/mol>0,故反应吸热;
通过计算可知,①④为吸热反应,
故选A.
点评 本题考查了通过断键吸收的能量和成键放出能量的大小比较来判断反应吸放热,应注意的是△H=断键吸收的能量-成键放出的能量.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe | B. | Cu | C. | Fe 和 Cu | D. | Cu 和 Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
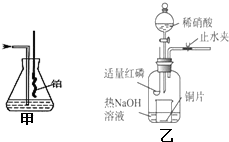 Ⅰ、实验室模拟氨催化氧化的装置如图甲:
Ⅰ、实验室模拟氨催化氧化的装置如图甲:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键能 | 键能 | 键能 | |||||
| H-H | 436 | Cl-Cl | 243 | H-Cl | 432 | ||
| S-S | 255 | H-S | 339 | C-F | 427 | ||
| C-Cl | 330 | C-I | 218 | H-F | 568 | ||
| C-O | 351 | H-O | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
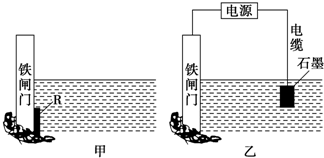 下面两个图都是金属防护的例子.
下面两个图都是金属防护的例子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3溶液 | B. | NaCl溶液 | C. | H2SO4溶液 | D. | K2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
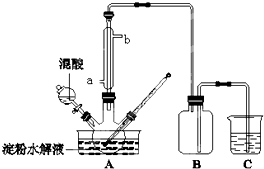 淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去),实验过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com