
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g) + 3H2(g) 2NH3(g) △H=-92.4 kJ/mol。
2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 3 | 0 | 放出热量b kJ |
| ③ | 2 | 6 | 0 | 放出热量c kJ |
下列叙述正确的是( )
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.平衡时氨气的体积分数:① > ③
D.N2的转化率:② > ① > ③
科目:高中化学 来源: 题型:
同周期主族元素,随原子序数递增,下列说法中错误的是
A.最外层电子数逐渐增多 B.元素最高正化合价均由+1递增到+7
C.原子半径逐渐减小 D.金属性逐渐减弱,非金属性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是( )
A.锗单质是一种优良的半导体材料 B.砹化银不溶于水也不溶于稀硝酸
C.硫酸镭是难溶于水的白色固体 D.硒化氢是无色、有毒、比硫化氢稳定的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
关于A(g)+2B(g)===3C(g)的化学反应,下列表示的反应速率最大的是( )
A.v(A)=0.6mol/(L·min) B.v(B)=1.2mol/(L·min)
C.v(C)=1.2mol/(L·min) D.v(B)=0.03mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的X(g)与Y(g)在密闭容器中进行可逆反应:X(g)+Y(g) 2Z(g)+W(s) ΔH <0,下列叙述正确的是( )
2Z(g)+W(s) ΔH <0,下列叙述正确的是( )
A.平衡常数K值越大,X的最大转化率越大
B.达到平衡时,反应速率v正(X)=2v逆(Z)
C.达到平衡后,降低温度,正向反应速率减小的倍数大于逆向反应速率减小的倍数
D.达到平衡后,升高温度或增大压强都有利于该反应平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示在密闭容器中反应:2SO2+O2 2SO3, △H < 0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.。
2SO3, △H < 0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.。
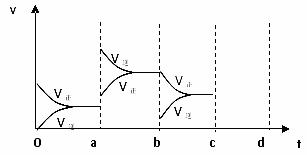
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子:aA 2+、bB +、cC 3-、dD - 都具有相同的电子层结构,则下列叙述正确的是 ( )
A、原子半径A>B>D>C
B、原子序数d>c>b>a
C、离子半径C>D>B>A
D、单质的还原性A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:(1)2 min末SO3的浓度;(2)2 min内SO2的平均反应速率(要求:书写完整的解题过程,否则不给分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答:
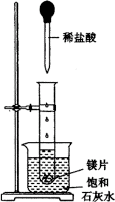
(1)实验中观察到的现象是____________________。(选填代号,3分)
A.试管中镁片逐渐溶解
B.试管中产生无色气泡
C.烧杯外壁变冷
D.烧杯底部析出少量白色固体
(2)试管中发生的反应属于____________________(选填“氧化还原反应”或“非氧化还原反应”)。
(3)写出有关反应的离子方程式________________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”“等于”)镁片和盐酸的总能量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com