
下列对一些实验事实的理论解释正确的是( )
选项 | 实验事实 | 理论解释 |
A | 深蓝色的[Cu(NH3)4]SO4溶液中加入乙醇析出晶体 | 乙醇增强了溶剂的极性,降低晶体的溶解度 |
B | 用KSCN检验溶液中的Fe3+ | Fe3+遇SCN-生成血红色沉淀 |
C | CH4熔点低于CO2 | 碳氢键比碳氧键的键长短、键能大 |
D | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
科目:高中化学 来源:2015-2016学年湖南师大附中高一下期中化学试卷(解析版) 题型:选择题
PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
A.PH3分子中存在极性共价键
B.P—H键键长比N—H键键长长
C.PH3沸点低于NH3沸点,因为P-H键键能低
D.PH3分子稳定性低于NH3分子,因为N-H键键能高
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北武汉华中师大一附高一下期中化学试卷(解析版) 题型:选择题
下列离子方程式正确的有
A.向10ml0.1mol/L的Ca(ClO)2的溶液中鼓入标态下的SO2气体44.8ml:
Ca2++2ClO- +2H2O+2SO2= CaSO4↓+2Cl- +4H++SO42-
B.向98.3%的浓硫酸中加入铜片并加热:Cu+4H++SO42-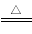 SO2↑+Cu2++2H2O
SO2↑+Cu2++2H2O
C.向NH4HCO3溶液中加足量浓NaOH溶液并加热:HCO3-+ OH- H2O +CO32-
H2O +CO32-
D.用氯化铵和消石灰两种固体混合加热制氨气:NH4++OH- NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高二下第四次半月考化学试卷(解析版) 题型:选择题
将CO2转化为甲醇的原理为CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
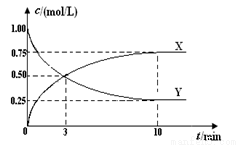
A.曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B.从反应开始到10min时,H2的反应速率υ(H2)=0.225 mol/(L·min)
C.平衡时H2 的转化率为75%
D.500 ℃时该反应的平衡常数K=3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高二下第四次半月考化学试卷(解析版) 题型:选择题
下列实验装置图(有些图中部分夹持仪器未画出)能达到其实验目的的是( )
|
|
A.证明酸性:盐酸>碳酸>苯酚 | B.溴水褪色一定产生了乙烯 |
|
|
C.分离溴乙烷和水 | D. 检查装置的气密性 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高二下第四次半月考化学试卷(解析版) 题型:选择题
下列晶体分类中正确的一组是( )
选项 | 离子晶体 | 原子晶体 | 分子晶体 |
A | NaOH | Ar | SO2 |
B | K2SO4 | 石墨 | S |
C | Ba(OH)2 | 金刚石 | 玻璃 |
D | CH3COONa | 水晶 |
|
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三5月月考理综化学试卷(解析版) 题型:填空题
己二酸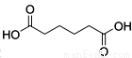 是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
是一种工业上具有重要意义的有机二元酸,在化工生产、有机合成工业、医药、润滑剂制造等方面都有重要作用,能够发生成盐反应、酯化反应等,并能与二元醇缩聚成高分子聚合物等,己二酸产量居所有二元羧酸中的第二位。实验室合成己二酸的反应原理和实验装置示意图如下:
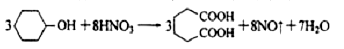
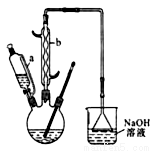
可能用到的有关数据如下:
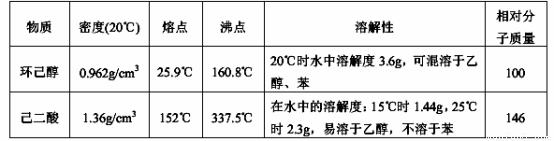
实验步骤如下:
I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。
II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。
IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。
V、粗产品经提纯后称重为5.7g。
请回答下列问题:
(1) 仪器b的名称为__________。
(2) 向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:____________________。
(3) 已知用NaOH溶液吸收尾气时发生的相关反应方程式为:
2NO2+2NaOH=NaNO2+NaNO3+H2O 、NO+NO2+2NaOH =2NaNO2+H2O ;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:____________ _________、___________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
(5)粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
已知: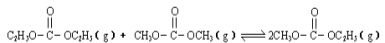 是碳酸甲乙酯的工业生产原理。下图是投料比[
是碳酸甲乙酯的工业生产原理。下图是投料比[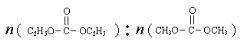 ]分别为3:1和1:1、反应物的总物质的量相同时,
]分别为3:1和1:1、反应物的总物质的量相同时,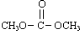 的平衡转化率与温度的关系曲线。下列说法正确的是
的平衡转化率与温度的关系曲线。下列说法正确的是
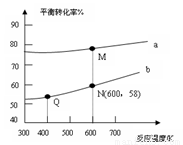
A.曲线b所对应的投料比为3:1
B.M点对应的平衡常数小于Q点
C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58
D.M点和Q点对应的平衡混合气体的总物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三第二轮限时训练四化学试卷(解析版) 题型:选择题
下列有关化学知识在生产、生活中应用的叙述正确的是
①工业上合成新型氮化硅(Si3N4)陶瓷需要在高温、空气气氛中进行 ②钢铁制品锈蚀主要是因为钢铁中含有碳而发生原电池反应,因此生铁炼钢时要尽可能完全除去生铁中的碳 ③海水淡化和工业生产及生活废水的再利用,是解决缺水问题的有效途径 ④高铁酸钠(Na2FeO4)和ClO2都能作净水剂,其原理完全相同 ⑤液氯罐泄漏时,可将其移入水塘中,并向水塘中加入生石灰⑥石油分馏、煤的气化、煤的干馏、海水制盐等都属于化学变化过程⑦水泥、玻璃、陶瓷是人们在生产、生活中用量最大的无机非金属材料⑧NO2、SO2 、CO2、PM2.5都是空气质量日报必须报道的大气污染物
A.①②③ B.②④⑧ C.③④⑤ D.③⑤⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com