
用NA表示阿伏加德罗常数,下列叙述正确的是( )
A.64 g SO2含有氧原子数为1NA
B.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数目为1 NA
C.标准状况下,22.4 L H2O的分子数为1NA
D.常温常压下,14 g N2含有分子数为0.5 NA
 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源:2014-2015学年黑龙江省绥化市三校高二上学期期中化学试卷(解析版) 题型:选择题
下列事实,不能用勒夏特列原理解释的是
A.氨水中加酸,NH的浓度增大
B.合成氨工业中不断从反应混合物中液化分离出氨气
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨控制在500 ℃左右的温度
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
Mg?AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为
2AgCl+ Mg === Mg2++ 2Ag +2Cl-。有关该电池的说法正确的是
A.Mg为电池的正极
B.负极反应为AgCl+e-===Ag+Cl-
C.不能被KCl 溶液激活
D.可用于海上应急照明供电
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高二10月月考化学试卷(解析版) 题型:选择题
有关甲、乙、丙、丁四个图示的叙述正确的是
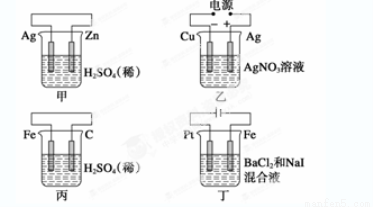
A.甲中负极反应式为2H++2e-===H2↑
B.乙中阳极反应式为Ag++e-===Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高一10月月考化学试卷(解析版) 题型:填空题
取1.43 g Na2CO3·10H2O溶于水配成100 mL溶液,Na+ 物质的量浓度为 ;取出20 mL该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.004 mol/L,加入蒸馏水的体积(设稀释时,对溶液体积的影响忽略不计)为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高一10月月考化学试卷(解析版) 题型:选择题
0. 5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的数目之比( )
A.5:2 B. 3:1 C.15:2 D. 1:3
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高一10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列对0.3mol/L硫酸钾溶液不正确的说法是( )
A. 1L溶液中含有0.6NA个钾离子
B. 1L溶液中含有钾离子和硫酸根离子总数为0.9NA
C. 2L溶液中钾离子浓度为1.2mol/L
D. 2L溶液中含有0.6NA个硫酸根离子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江安达市高二第一次月考试卷化学试卷(解析版) 题型:填空题
(11分)高炉炼铁过程中发生的主要反应为:
温度/℃ | 1 000 | 1 150 | 1 300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
 Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) 
 Fe(s)+CO2(g).该反应在不同
Fe(s)+CO2(g).该反应在不同
温度下的平衡常数如下:请回答下列问题:
(1)该反应的平衡常数表达式K= ,
ΔH 0(填“>”、“<”或“=”);
(2)在一个容积为10 L的密闭容器中,1 000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= ,CO的平衡转化率= ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是( )
A减少Fe的量 B增加Fe2O3的量 C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江哈尔滨第三十二中学高二上学期期中考试化学卷(解析版) 题型:选择题
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是( )
4NO(g)+ 6H2O(g),下列叙述正确的是( )
A.达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com