
| A. | NaCl和KNO3 | B. | BaCO3和MnO2 | C. | CaCO3和Na2CO3 | D. | KOH和NaNO3 |
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
| 实验序号 | 温度/℃ | 压强/kPa | V(CH4)/mol•L-1•s-1 | V(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3 H2O═Fe(OH)3↓+3 H+ | |
| B. | 用小苏打治疗胃酸过多:HCO3ˉ+H+═CO2↑+H2O | |
| C. | 实验室用浓盐酸与MnO2反应制氯气:2Cl-+MnO2+2H+=Mn2++2H2O+Cl2↑ | |
| D. | 用FeCl3溶液腐蚀电路板:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、U形管、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.
现有纯铁片、纯银片、纯铜片,稀硫酸、FeSO4 溶液、Fe2(SO4)3溶液、U形管、导线若干,请运用原电池原理设计实验,验证Cu2+、Fe3+的氧化性强弱.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、K、Ca | B. | N、P、S | C. | F、Cl、S | D. | O、S、Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| M | N | ||
| X | Y |
 ,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.
,(MN)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为(CN)2+2NaOH=NaCN+NaCNO+H2O,若还原性MN->I-,将适量的(MN)2、I2、KMN、KI在水中混合后,反应的离子方程式为I2+2CN-=2I-+(CN)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
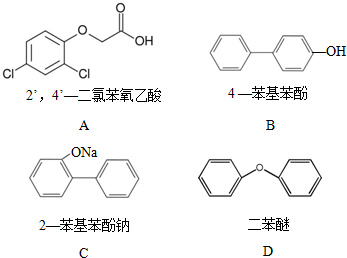
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
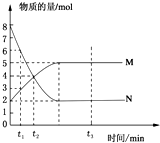 一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com