
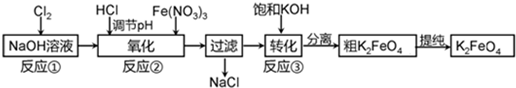
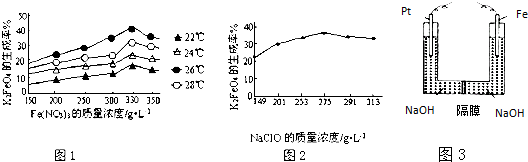


科目:高中化学 来源: 题型:
| A、焦炭具有强还原性,高温下能将二氧化硅还原为硅 |
| B、晶体硅用于制作半导体材料是因其熔点高、硬度大 |
| C、二氧化锰具有强氧化性,故能将双氧水氧化为氧气 |
| D、Fe比Cu活泼,所以FeCl3溶液可以腐蚀线路板上的Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
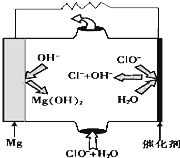 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:| 1 |
| 2 |
| 1 |
| 2 |
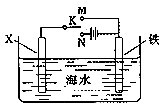
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放电时,电子从正极流向电源的负极 | |||
| B、放电时,Li+向负极移动 | |||
C、该电池的总反应为LiNiO2+6C
| |||
| D、充电时,阳极发生的电极反应为Li1-xNiO2+xLi++x e-═LiNiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe+HCl |
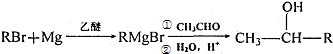
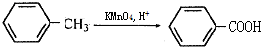
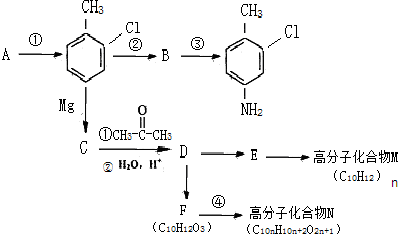
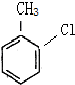 这一途径外,另一途径生成的中间产物的结构简式为
这一途径外,另一途径生成的中间产物的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过量的碱液除去CO2中混有的少量HCl气体 |
| B、用饱和食盐水除去氯气中混有的HCl气体 |
| C、用升华的方法除去食盐中少量的I2 |
| D、用过量的氯化钡溶液除去亚硫酸钠溶液中的少量SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com