
| m |
| M |
| 16g |
| 32g/mol |


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
A、CaCO3
| ||||
| B、NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g)△H=+185.57KJ?mol-1能自发进行,原因之一是体系有自发地向混乱度增加的方向转变的倾向 | ||||
| C、因为焓变和熵变都与反应的自发性有关,因此焓变火熵变均可以单独作为反应自发性的判据 | ||||
| D、某反应 H<0,则该反应在任意条件下均可自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、①③④⑦ |
| C、①③④⑤⑦ | D、①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 1 | 2 |
| 步骤 | 滴加3~10滴浓硫酸 | 滴加10~20滴6mol/L氢氧化钠溶液 |
| K2Cr2O7溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
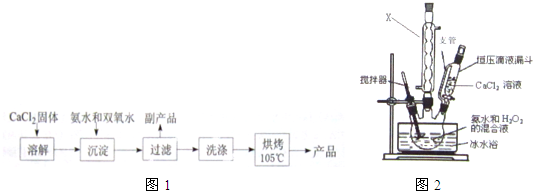
| 实验序号 | 第1次 | 第2次 | 第3次 | 第4次 |
| 消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
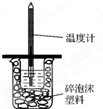 如图所示,50mL0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在装置中进行中和反应.通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:
如图所示,50mL0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在装置中进行中和反应.通过测定反应过程中所放出的热量,可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ?mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ?mol-1 | ||
B、燃料电池中将甲醇蒸气转化为氢气的热化学方程式是:CH3OH(g)+
则CH3OH(g)的燃烧热为192.9 kJ?mol-1 | ||
| C、H2(g)的燃烧热是285.8 kJ?mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ?mol-1 | ||
D、葡萄糖的燃烧热是2800 kJ?mol-1,则
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com