
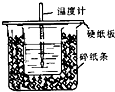
 中和热的测量,是一个重要的定量实验.
中和热的测量,是一个重要的定量实验.分析 ①根据量热计的构造来判断该装置的缺少仪器;
②大烧杯上如不盖硬纸板,会使一部分热量散失;
③反应放出的热量和所用酸以及碱的量的多少有关,并根据中和热的概念和实质来回答.
解答 解:①由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
②大烧杯上如不盖硬纸板,会使一部分热量散失,求得的中和热数值将会减小,故答案为:偏小;
③反应放出的热量和所用酸以及碱的量的多少有关,用60mL0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.50mol/L盐酸进行上述实验,测得中和热数值相等;
故答案为:不相等;相等;因为中和热是指酸跟碱发生中和反应生成1molH2O所放出的热量,与酸碱的用量无关.
点评 本题考查了中和热的测定方法,题目难度中等,明确中和热的测定原理为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 2 A+3 B→2 C | B. | A+3 B→2 C | C. | 3 A+B→2 C | D. | A+B→C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
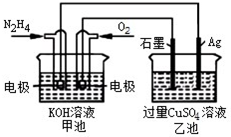
| A. | 甲池中,负极反应为N2H4-4e-═4H++N2 | |
| B. | 甲池溶液pH 保持不变,乙池溶液pH 减小 | |
| C. | 甲池中消耗2.24LO2,此时乙池中理论上多产生12.8g 固体 | |
| D. | 反应一段时间后,向乙池中加一定量CuO 固体,能使CuSO4溶液恢复到原浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 苯与液溴在催化剂作用下生成溴苯 | |
| C. | 乙烯与氢气在催化剂作用下生成乙烷 | |
| D. | 乙醇在铜催化、加热条件下与氧气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗铜精炼时,阴极质量增加:Cu2++2e-═Cu | |
| B. | 明矾可用作净水剂:Al3++3H2O═Al(OH)3↓+3H+ | |
| C. | 用食醋除去水壶中的水垢(CaCO3):2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 向氢氧化镁浊液中滴入酚酞溶液,溶液变红:Mg(OH)2(s)?Mg2+(aq)+2OH- (aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应达到化学平衡状态时,正、逆反应的速率都为0 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 可以找到一种催化剂使水变成油 | |
| D. | 增大反应物的浓度、提高反应温度都能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2、Na2CO3 | B. | Ba(OH)2、NaHSO4 | C. | AlCl3、NH3•H2O | D. | Al2(SO4)3、NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com