
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 熔点由高到低:Na>Mg>Al | |
| C. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 四种气态氢化物按稳定性:SiH4<CH4<H2O<HF |
分析 A.均为分子晶体,相对分子质量大的熔点高;
B.均为金属晶体,离子半径小、电荷高的熔点高;
C.均为原子晶体,原子半径小的硬度大;
D.非金属性越强,氢化物越稳定.
解答 解:A.均为分子晶体,相对分子质量大的熔点高,则晶体熔点由低到高:CF4<CCl4<CBr4<CI4,故A正确;
B.均为金属晶体,离子半径小、电荷高的熔点高,则熔点由高到低:Al>Mg>Na,故B错误;
C.均为原子晶体,原子半径小的硬度大,则硬度由大到小:金刚石>碳化硅>晶体硅,故C正确;
D.非金属性越强,氢化物越稳定,则气态氢化物的稳定性:SiH4<CH4<H2O<HF,故D正确;
故选B.
点评 本题考查晶体及性质,为高频考点,把握晶体类型的判断、物质性质比较方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题
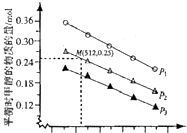 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.| 化学键 | C=0 | H-H | C-C | C-H | 0-H | C-0 |
| 键能/kJ.mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
| 成分 | 含量/(mg/L) | 成分 | 含量(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3-; | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4 | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | 进行焰色反应,连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 浓硫酸不慎沾在皮肤上,应立即用干布拭去,然后用水冲洗,最后再涂上3%-5%的小苏打溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | BaCl2与K2CO3溶液反应 | B. | CO2与Ba(OH)2溶液反应 | ||
| C. | Ba(NO3)2与Na2CO3溶液反应 | D. | Ba(OH)2与少量NaHCO3溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到反应限度时SO2的消耗速率必定等于SO3的生成速率相等 | |
| B. | 平衡时SO2、O2、SO3的分子数之比为2:1:2 | |
| C. | 平衡时SO2的消耗速率必定等于O2的生成速率的2倍 | |
| D. | 若反应在恒容容器中进行,气体密度保持不变,可以判定反应到达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
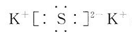 ,A属于离子化合物.
,A属于离子化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学中的某些元素与生命活动密不可分.请回答下列问题:
化学中的某些元素与生命活动密不可分.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
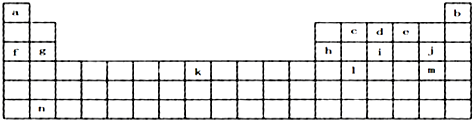
 ,元素c在周期表的位置第二周期IVA族
,元素c在周期表的位置第二周期IVA族查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com