
| m |
| M |
| 1.92g |
| 64g/mol |
| 0.06mol×2 |
| 8 |
| 0.06mol×3 |
| 8 |
| 0.0225mol |
| 0.1L |


科目:高中化学 来源: 题型:
| A、熔点1070℃,易溶于水,水溶液能导电 |
| B、能溶于CS2,熔点112.8℃,沸点444.6℃ |
| C、熔点97.81℃,质软,导电,密度0.97g/cm3 |
| D、熔点2200℃,不溶于水,熔融时不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 140℃ |
| 催化剂 |
| 140℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
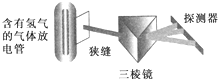 在实验室中用下列的装置可以得到氢原子光谱,实验证明该光谱为线状光谱,该光谱的发现在原子结构的认识过程中,有极为重要的意义,根据它产生了( )
在实验室中用下列的装置可以得到氢原子光谱,实验证明该光谱为线状光谱,该光谱的发现在原子结构的认识过程中,有极为重要的意义,根据它产生了( )| A、卢瑟福核式原子模型 |
| B、汤姆逊“葡萄干布丁”模型 |
| C、玻尔核外电子分层排布模型 |
| D、原子结构的量子力学模型 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com