

 +H2O.
+H2O. 分析 (1)苯酚钠通入二氧化碳生成苯酚和碳酸氢钠;
(2)根据甲苯与浓硫酸和浓硝酸的混酸加热反应生成三硝基甲苯和水发生的是取代反应进行解答;
(3)溴乙烷与NaOH的乙醇溶液共热,发生消去反应生成乙烯;
(4)2-羟基丙酸CH3CH(OH)COOH,分子间酸脱羟基、醇脱氢发生酯化反成六元环酯.
解答 解:(1)碳酸的酸性比苯酚的酸性强,所以苯酚钠通入二氧化碳生成苯酚和碳酸氢钠,反应的化学方程式为:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3,
故答案为:C6H5ONa+CO2+H2O→C6H6OH+NaHCO3;
(2)甲苯可以和浓硝酸之间发生取代反应生成2,4,6-三硝基甲苯,即TNT,反应的化学方程式为: ;
;
故答案为: ;
;
(3)溴乙烷与NaOH的乙醇溶液共热,发生消去反应生成乙烯,溴乙烷与氢氧化钠乙醇溶液加热反应方程式:CH3CH2Br+NaOH $→_{△}^{醇}$CH2=CH2↑+NaBr+H2O,
故答案为:CH3CH2Br+NaOH $→_{△}^{醇}$CH2=CH2↑+NaBr+H2O;
④2-羟基丙酸CH3CH(OH)COOH,发生酯化反,酸脱羟基、醇脱氢,分子间脱水形成的含六元环的化合物,反应为2CH3CHOHCOOH→ +H2O,
+H2O,
故答案为:2CH3CHOHCOOH→ +H2O.
+H2O.
点评 本题考查有机物的机构和性质,为高考常见题型,注意把握有机物的官能团的性质以及相关方程式的书写,为解答该题的关键,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:填空题
 Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
Mn.Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:| 元素 | Mn | Fe | |
| 电离能 KJ/mol | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
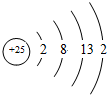 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);
,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,对此,你的解释是由Mn2+转化为Mn3+时,3d能经由较稳定的3d5半充满状态转变为不稳定的3d4状态(或Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 111 | B. | 161 | C. | 272 | D. | 433 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
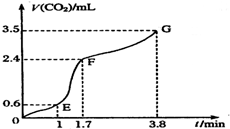 现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:
现欲用碳酸钙固体和稀盐酸反应制取CO2气体,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
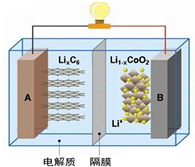 随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”. 特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许 Li+通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 充电时Li+从右边流向左边 | |
| B. | 放电时,正极锂的化合价未发生改变 | |
| C. | 充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有④ | B. | ①②④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Cl | C. | K | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 金刚石的硬度大于硅,其熔、沸点也高于硅 | |
| C. | NaF、NaCl、NaBr、NaI的熔点依次降低 | |
| D. | F2、Cl2、Br2、I2的沸点依次升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com