
【题目】下列说法不正确的是
A.浓硫酸和浓硝酸都具有强氧化性,都能把 HCl 气体氧化
B.非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物
C.同温同压下,两份相同质量的锌粉,分别与足量的稀硫酸和浓硫酸反应,产生气体的体积相同
D.将 CO2 气体通入BaCl2 溶液中至饱和未见沉淀生成,继续通入 NH3 则有沉淀生成
【答案】A
【解析】
A.氯化氢实验室制法是用浓硫酸与氯化钠固体加强热制取氯化氢气体,若浓硫酸能将HCl气体氧化,就不能用于制备氯化氢,即浓硫酸不能氧化氯化氢气体,故A错误;
B.一氧化碳是非金属氧化物,但不是酸性氧化物,金属氧化物多数可以和酸反应生成盐和水,故多数金属氧化物为碱性氧化物,故B正确;
C.同温同压下,相同质量的铁粉物质的量相同,与足量的酸反应Zn+H2SO4=ZnSO4+H2↑,Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O,故产生气体的体积均相同,故C正确;
ZnSO4+SO2↑+2H2O,故产生气体的体积均相同,故C正确;
D.将 CO2 气体通入BaCl2 溶液中,根据强酸制弱酸的原理,二者不反应,不生成沉淀,但二氧化碳可溶于水,形成二氧化碳的饱和溶液,继续通入NH3 可形成碳酸铵,碳酸根离子与钡离子反应生成碳酸钡沉淀,故D正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,错误的是
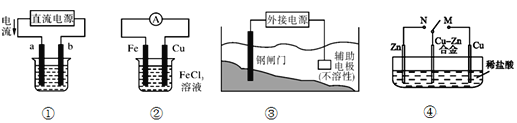
A. 用装置①在铁上镀锌,则a为铁,b为锌
B. 装置②的总反应是:Fe+2Fe3+=3Fe2+
C. 装置③的反应实质是电解水
D. 装置④中开关由M改置于N时,Cu—Zn合金的腐蚀速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1871年门捷列夫最早预言了类硅元素锗,锗元素在元素周期表中与硅元素同族,并位于硅的下一周期。1886年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。
已知:①丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀:
②GeCl4易水解,在浓盐酸中溶解度低。

(1)锗元素的原子序数为:___________;锗元素在元素周期表中的位置是:_____________。
(2)GeCl4的结构与SiCl4相似,写出GeCl4的电子式:_______________。
(3)简述步骤①中提高酸浸效率的措施____________、_____________(写两种)。
(4)步骤②操作A是___________(填操作名称)。
(5)步骤③中的物质在___________(填仪器名称)中加热。
(6)步骤④不选用稀盐酸,而选用浓盐酸的原因可能是__________、________(写出两点)。
(7)写出步骤⑤的化学方程式________________。
写出步骤⑦的化学方程式________________。
(8)请写出一种证明步骤⑦反应完全的操作方法__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向碳酸溶液中滴加NaOH溶液,测得碳酸中含碳微粒的物质的量分数随pH变化如图所示,下列说法不正确的是:
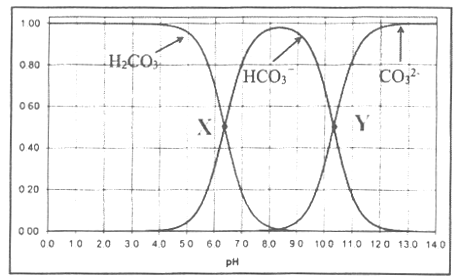
A.除去NaCl溶液中Na2CO3的方法是向其中加入盐酸至pH=7
B.X、Y为曲线两交叉点。由X点处的pH,可计算Ka1(H2CO3)
C.pH=10的溶液中c(H+)+c(Na+)=c(HCO3-)+2 c(CO32-)+c(OH-)
D.将CO2通入NaOH溶液制取Na2CO3,应控制pH>12.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:3A(g)+B(g)=2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为:
①v(A)=0.6 mol· L-1·min-1 ②v(B)=0.45 mol· L-1·min-1
③v(C)=0.015 mol· L-1·min-1 ④v(D)=0.45 mol· L-1·min-1
则此反应在不同条件下进行最快的是
A.③B.①C.②D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 均为短周期元素组成的物质,它们之间符合如下转化关系:
![]()
(1)若A 为可使湿润的红色石蕊试纸变蓝的气态氢化物,X 为水,D 为重要的化工原料。
① A 的电子式为_________________,A→B 的化学方程式为______________________。
②A 和 D 发生化合反应得到的化合物 E 的化学式是___________,用离子方程式表示检验E中阳离子的方法________________。
③写出D的稀溶液与Cu反应的离子方程式____________________________。
(2)若A为非金属单质,X为水,该转化关系为工业生产D的一系列反应。
①将B通入溴水中颜色褪去,体现了B的___________________性,写出该变化的化学方程式________________________。
②A和H2发生化合反应得到的E,在B与E的反应中,氧化产物和还原产物的质量比为_______________________________。
③写出D的浓溶液与Cu反应的化学方程式_________________________________________________________。
(3)若A为烃的含氧衍生物,医疗上常用75%(体积分数)A的水溶液作消毒剂,X为甲醇(CH3OH)。
①A→B的化学方程式为____________________________;C→D的化学方程式为_____________________________________。
②下列说法正确的是___________________________________(选填序号字母)
a. A 可通过葡萄糖分解反应得到 b. B 的官能团的结构简式为-COH
c. C 可与 NaHCO3 反应产生 CO2 d. A 与X 互为同系物
③已知:CH≡CH 在一定条件下可与C反应得到E(结构简式为 CH2=CHOOCCH3),则上述反应的反应类型为_______________________,E中的官能团名称为_____________,E发生加聚反应的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,金属—空气电池的研究和应用取得很大进步,这种新型燃料电池具有比能量高、污染小、应用场合多等多方面优点。铝—空气电池工作原理如图所示。关于金属—空气电池的说法不正确的是( )

A.铝—空气电池(如上图)中,铝作负极,电子通过外电路到正极
B.为帮助电子与空气中的氧气反应,可使用活性炭作正极材料
C.碱性溶液中,负极反应为Al(s)+3OH-(aq)=Al(OH)3(s)+3e-,每消耗2.7 g Al(s),需耗氧6.72 L(标准状况)
D.金属—空气电池的可持续应用要求是一方面在工作状态下要有足够的氧气供应,另一方面在非工作状态下能够密封防止金属自腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
Si(s)+4HCl(g) △H=+QkJ·mol-1(Q>0),某温度、压强下,将一定量的反应物通入密闭容器中进行以上的反应(此条件下为可逆反应),下列叙述正确的是
A. 反应过程中,若增大压强能提高SiCl4的转化率
B. 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ
C. 反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min
D. 当反应吸热为0.025QkJ时,生成的HCl与100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com