
| A. | 1:2 | B. | 2:5 | C. | 1:10 | D. | 1:8 |
分析 由CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O可知,V(CH4):V(O2)=1:2,恰好完全反应,爆炸最为剧烈,空气中约含O2为20%,以此求得V(CH4):V(空气).
解答 解:由CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O可知,V(CH4):V(O2)=1:2,恰好完全反应,爆炸最为剧烈,空气中约含O2为20%,故V(CH4):V(空气)=1:$\frac{2}{20%}$=1:10.
故选C.
点评 本题考查化学方程式的有关计算,难度不大,明确同温同压下气V(CH4):V(O2)=1:2,恰好完全反应,爆炸最为剧烈是解题关键.


科目:高中化学 来源: 题型:解答题
 甲醚(CH3OCH3)被称为21试剂的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
甲醚(CH3OCH3)被称为21试剂的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变温度对反应速率无影响 | |
| B. | 升高温度能加快反应速率 | |
| C. | 使用催化剂能加快反应速率 | |
| D. | 该反应的化学方程式为:2CO+2NO═N2+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
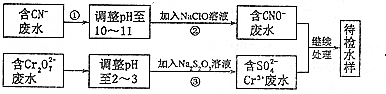
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
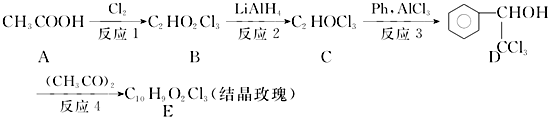
 .
.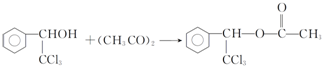 .
. ,F与氯仿合成D的反应方程式为
,F与氯仿合成D的反应方程式为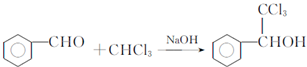 .已知2分子F在KCN存在下可通过授受H反应生成安息香
.已知2分子F在KCN存在下可通过授受H反应生成安息香 ,请写出上述反应方程式
,请写出上述反应方程式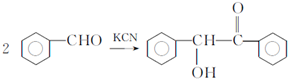 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 盐酸的体积/mL | 50 | 50 | 50 |
| 混合物的质量/g | 9.2 | 15.7 | 27.6 |
| CO2的体积(标准 状况下)/L | 2.24 | 3.36 | 3.36 |
| A. | 盐酸的物质的量浓度为3.0 mol•L-1 | |
| B. | 根据表中数据能计算出混合物中NaHCO3的质量分数为45.65% | |
| C. | 加入混合物9.2 g时盐酸过量 | |
| D. | 15.7 g混合物恰好与盐酸完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 根据如图的物理模型,回答问题:
根据如图的物理模型,回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
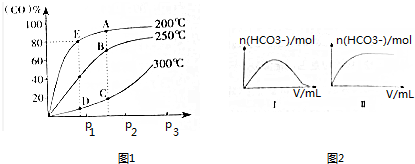
| H2CO3 | H2C2O4 | HNO2 | HClO |
| K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.3×10-5 | K=7.2×10-4 | K=2.9×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com