
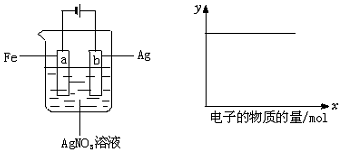
| A. | (1)(2) | B. | (3)(4) | C. | (1)(2)(4) | D. | (1)(2)(5) |
分析 题给装置实验为Fe、Ag、AgNO3构成的电解池,该电解池中,活泼金属Fe连接原电池的负极为阴极,Ag连接原电池的正极为阳极,该装置实际上是在铁的表面电镀银,电解质溶液的浓度不变,而图b中,Y轴表示某个量不变,以此解答该题.
解答 解:根据图中装置试验,Fe、Ag、AgNO3构成的电解池,
由图a可知,Ag连接电源的正极,则为阳极,电解质溶液为硝酸银溶液,则该装置实际上是在铁的表面电镀银,电解质溶液的浓度不变,即Ag+、NO3-的浓度不变,溶液的浓度及pH不变,图b中,Y轴表示某个量不变,
(1)阳极Ag溶解Ag-e-=Ag+,阴极铁上银离子得电子析出金属银Ag++e-=Ag,溶液中c(Ag+)不变;
(2)硝酸根离子未参与电极反应,所以c(NO3-)不变,则c(AgNO3)不变;
(3)a棒铁棒连接电源的负极为电解池的阴极,银离子得电子析出金属银Ag++e-=Ag,所以质量增加;
(4)b棒Ag连接电源的正极,则为阳极,Ag-e-=Ag+,质量在减轻;
(5)该反应本质为在铁的表面电镀银,电解质溶液的浓度不变,溶液的pH不变,
所以y轴可表示(1)(2)(5),
故选D.
点评 本题考查电解池的工作原理,为高频考点,侧重考查学生的分析能力,注意把握电镀池的工作原理,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-═BaSO4↓ | |
| D. | 氧化镁与稀硫酸混合:MgO+2H+═Mg2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
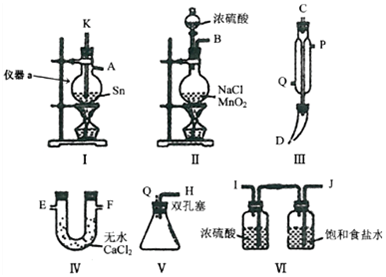
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3CuS+8HNO3═3Cu(NO3)2+2NO↑+3S↓+4H2O | |
| B. | Br2+2KOH═KBr+KBrO+H2O | |
| C. | 3H2O2+2KCrO2+2KOH═2K2CrO4+4H2O | |
| D. | 3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向盛有1mL浓硫酸的试管中加入5mL 0.1mol•L-1 的 K2Cr2O7溶液 | 溶液橙色变深 | 増大生成物浓度,平衡Cr2O72-(橙色)+H2O?2CrO42- (黄色)+2H+逆向移 动 |
| B | 向Mg(OH)2悬浊液中加入少量 氯化铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg(OH)2+2NH4+?Mg2++2NH3•H2O具有可逆性 |
| C | 白铁皮(镀锌铁)出现刮痕后浸泡 在饱和食盐水中,一段时间后滴入几滴K3[Fe(CN)6]溶液 | 无明显现象 | 该过程未发生原电池反应 |
| D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火 焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
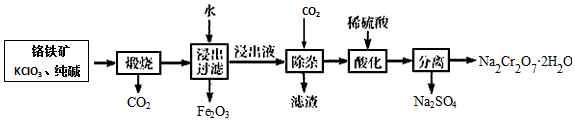
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com