
| A. | HCl(澄清石灰水) | B. | NO2(H2O) | C. | SO2(H2O2溶液) | D. | Cl2(NaOH溶液) |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 5种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 2:2:3 | C. | 3:3:2 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| B. | 化学反应涉及化学键的断裂和生成,而且还伴随着能量的变化 | |
| C. | 化学反应速率的大小主要取决于反应物的本身性质 | |
| D. | CO2(g)+C(s)?2CO(g)△H>0,△S>0,该反应常温下不能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
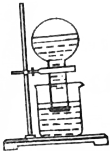 甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.
甲同学按如图所示装置做新制氯水受日光照射分解放出O2的验证实验,结果现象不明显.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
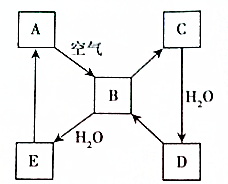 如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
如图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
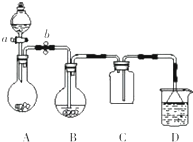 某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).
某化学小组设计了如图所示装置.用以探究Cu跟浓H2SO4的反应并收集少量气态产物(加热及夹持装置省略).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com