
| A、第四周期第ⅡA族 |
| B、第五周期第ⅣB族 |
| C、第五周期第IVA族 |
| D、第五周期第ⅡA族 |
科目:高中化学 来源: 题型:
A、某溶液
| ||
B、某溶液
| ||
C、某溶液
| ||
D、某溶液
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CS2分子的立体构型为V形 |
| B、ClO3-的空间构型为平面三角形 |
| C、CH4和SO32-的中心原子均为sp3杂化 |
| D、PCl5中所有原子均满足最外层8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钡的化学式为Ba2O2 |
| B、1mol过氧化钡与足量水反应生成1mol氧气 |
| C、晶体中阴阳离子个数比为2:1 |
| D、过氧化钠和过氧化钡都是强氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(X)?c2(Y) |
| c2(Z)?c2(W) |
| A、升高温度,平衡常数K一定增大 |
| B、增大压强,W(g)质量分数增加 |
| C、该反应的化学反应方程式为X+2Y?2Z+2W |
| D、增大X(g)浓度,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
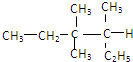 无标题的正确的名称是( )
无标题的正确的名称是( )| A、3,3-二甲基-4-乙基戊烷 |
| B、3,3-二甲基-2-乙基戊烷 |
| C、3,4,4-三甲基己烷 |
| D、3,3,4-三甲基己烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com