
 ,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。
,该分子中有________个σ键,________个π键,有________种极性键,________(填“有”或“没有”)非极性键。科目:高中化学 来源:不详 题型:单选题
| A.在离子晶体中不可能存在非极性键 |
| B.在共价化合物的分子晶体中不可能存在离子键 |
| C.在极性分子中不可能存在非极性键 |
| D.在原子晶体中不可能存在极性共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.[Co(NH3)4Cl2]Cl | B.[Co(NH3)3Cl3] |
| C.[Co(NH3)6]Cl3 | D.[Cu(NH3)4]Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
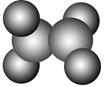
| A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键 |
| B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键 |
| C.C—H之间是sp2形成的σ键,C—C之间是未参加杂化的2p轨道形成的π键 |
| D.C—C之间是sp2形成的σ键,C—H之间是未参加杂化的2p轨道形成的π键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.键角决定了分子的结构 |
| B.共价键的键能越大,共价键越牢固,含有该键的分子越稳定 |
| C.CH4、CCl4中键长相等,键角不同 |
D.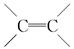 中的键能是C—C中的键能的两倍 中的键能是C—C中的键能的两倍 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.共价键是通过形成共用电子对或原子轨道重叠形成的 |
| B.形成共价键的原子之间电负性相同或相差不大 |
| C.一般情况下一个原子有几个不成对电子就会和几个自旋相反的未成对电子成键 |
| D.共价键是通过共用电子对形成的,不属于电性作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.炒菜时放入食盐并不破坏NaCl中的化学键 |
B.HCl的电子式是H+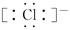 |
| C.NaCl熔化时破坏共价键 |
| D.HCl的结构式是H—Cl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.8个中子的碳原子的核素符号:12C |
B.HF的电子式: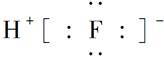 |
C.Cl-离子的结构示意图: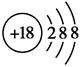 |
| D.CO2的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 SO2(g) ΔH=-297.16 kJ·mol-1,
SO2(g) ΔH=-297.16 kJ·mol-1, 2SO3(g) ΔH=-196.6 kJ·mol-1。
2SO3(g) ΔH=-196.6 kJ·mol-1。| A.1 mol SO2(g)的能量总和大于1 mol S(s)和1 mol O2(g)的能量总和 |
| B.将2 mol SO2(g)与1 mol O2(g)在一定条件下充分反应,放出196.6 kJ的热量 |
| C.S(g)+O2(g)=SO2(g) ΔH=-Q,Q值小于297.16 kJ |
| D.当1 mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com