
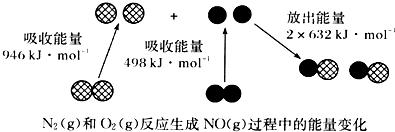
| A. | 1molN2(g)和NA个O2(g)反应放出的能量为180 kJ | |
| B. | 1molN2(g)和1molO2(g)具有总能量小于2molNO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | 吸热反应一定需要加热才能发生 |
分析 A、分析能量变化黑球代表氧原子,依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算判断;
B、依据A计算的焓变判断反应能量变化,结合反应前后能量守恒分析;
C、氮气和氧气在放电条件才能反应;
D、一个化学反应是吸热还是放热与反应条件无关.
解答 解:A、焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2=2NO,△H=946KJ/mol+498KJ/mol-2×632KJ/mol=180KJ/mol,反应是吸热反应,故A错误;
B、依据A计算可知反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故B正确;
C、通常情况下,N2(g)和O2(g)混合不能直接生成NO,故C错误;
D、一个化学反应是吸热还是放热与反应条件无关,氢氧化钡晶体和氯化铵晶体的反应属于吸热反应,在常温下即可进行,故D错误;
故选B.
点评 本题考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
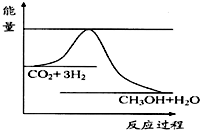 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
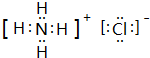 ;I分子的空间构型为直线形.
;I分子的空间构型为直线形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
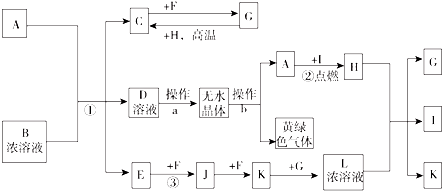
 在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题:
在图所示物质的转化关系中,D在常温下为无色无味的液体(反应条件均已省略).请回答下列问题: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
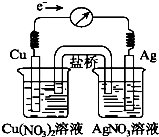 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | 当电流计指针指向0时,该反应达平衡,平衡常数K=0 | |
| C. | 若向硝酸银溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 | |
| D. | 向硝酸铜溶液中加入NaOH固体,随着NaOH量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
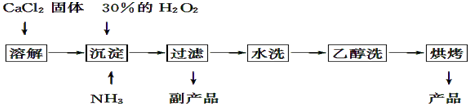
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
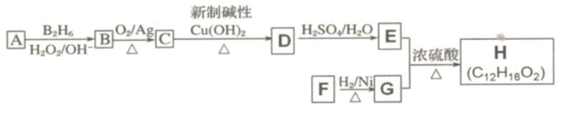
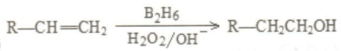
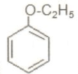 是同分异构体
是同分异构体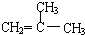 .
.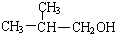 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2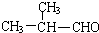 +2H2O.
+2H2O.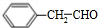 ;F分子中最多有15个原子共面.
;F分子中最多有15个原子共面.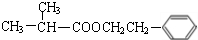 +NaOH$\stackrel{△}{→}$
+NaOH$\stackrel{△}{→}$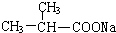 +
+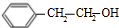 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与氨水的反应:H++OH-═H2O | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 铝与氢氧化钠溶液反应:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氯气通入FeCl3溶液中:Cl2+Fe2+═Fe3++2Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com