
 +CaCl2+H2O
+CaCl2+H2O
分析 (1)①根据烷烃与卤素单质在光照条件下发生取代反应得到卤代烃;②根据烯烃与卤化氢能发生加成反应得到卤代烃;根据产物是否纯净来解答;
(2)工艺一制取要经过多步反应制得,副产物多,原子利用率低;工艺二原子利用率为100%,原子利用率高.
解答 解:(1)①因烷烃与卤素单质在光照条件下发生取代反应得到卤代烃,所以用乙烷制备氯乙烷的化学方程式是CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl,
故答案为:CH3CH3+Cl2$\stackrel{光照}{→}$CH3CH2Cl+HCl;取代反应;
②因烯烃与卤化氢能发生加成反应得到卤代烃,所以用乙烯制备氯乙烷的化学方程式是:CH2=CH2+HCl→CH3CH2Cl,
由乙烷与氯气在光照条件下发生反应得到的产物有:一氯乙烷,1,1-二氯乙烷,1,2-二氯乙烷,1,1,2-三氯乙烷,1,1,2,2-四氯乙烷,1,1,1,2-四氯乙烷,1,1,1,2,2-五氯乙烷,六氯乙烷和氯化氢,产物不唯一,而乙烯和卤化氢能发生加成反应得到氯乙烷,产物只有一种,
故答案为:CH2=CH2+HCl→CH3CH2Cl;加成反应;②;第①种方法生成的物质将是一系列混合物,第②种方法生成纯净的氯乙烷;
(2)工艺一除生成环氧乙烷外还有CaCl2和H2O的生成,副产物多,原子利用率低;工艺二乙烯和氧气反应全部生成了环氧乙烷,原子利用率为100%,原子利用率高;工艺二:乙烯和氧气反应全部生成了环氧乙烷,原子利用率为100%,符合绿色化学的原则,故选工艺二;
故答案为:<;=;二.
点评 本题考查了有机物的制备和方案的评价,题目难度不大,注意对有机物结构和性质的掌握.


科目:高中化学 来源: 题型:选择题
| A. | Br- | B. | OH- | C. | HCO3- | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
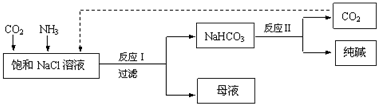
| A. | 反应Ⅰ原理为CO2+NH3+NaCl+H2O→NaHCO3↓+NH4Cl | |
| B. | 向饱和NaCl溶液中先通入足量的CO2,再通入足量的NH3 | |
| C. | 反应Ⅰ生成的沉淀,经过过滤、洗涤、煅烧可得到纯碱 | |
| D. | 往母液中通入氨气,加入细小的食盐颗粒并降温,可使氯化铵析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>W | |
| B. | ZW2电子式为 | |
| C. | 片状Y在空气中点燃时现象不剧烈 | |
| D. | 已知XW2熔点为-107℃、沸点为12.5℃,熔融时不导电,可说明固态XW2为共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应,只要是放热反应,理论上都能设计成原电池 | |
| B. | 周期表中所有元素都是从自然界中发现的 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 原子结合成分子过程中一定释放出能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 预期现象和结论 |
| 取少许吸收液于试管中滴加1~2滴0.01mol•L-1KMnO4溶液 | 若溶液褪色则假设1成立,否则假设1不成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com