
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种类最多的元素,Y原子基态时最外层电子数是其内层电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为________,1 mol Y2X2含有σ键的数目为________。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是________。
 (3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是________。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是________。
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯
化物的化学式是________,它可与浓盐酸发生非氧化还
原反应,生成配合物HnWCl3,反应的化学方程式为
_________________________________。
解析 本题考查杂化类型、化学键的判断,根据晶胞写化学式及物质沸点高低比较等知识,意在考查考生综合运用物质结构原理的能力。X是形成化合物种类最多的元素,则为H元素,Y原子基态时最外层电子数是其内层电子总数的2倍,则Y为C元素;由Z原子基态时2p原子轨道上有3个未成对电子,推出Z为N元素,W的原子序数为29,则为Cu元素。
(1) C2H2中C原子轨道的杂化类型是sp杂化;1 mol C2H2中含有3 mol σ键,
2 mol π键。
(2)NH3的沸点比CH4高的原因是NH3分子间存在氢键,而氢键的作用力比范
德华力强。
(4)根据晶胞示意图,Cu为4个,Cl为8× +6×
+6×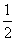 =4(个),则化学式为CuCl,
=4(个),则化学式为CuCl,
其与浓盐酸发生非氧化还原反应生成HnCuCl3,由于Cu显+1价,推出n=2,
则反应的化学方程式为:2HCl+CuCl===H2CuCl3。
答案 (1)sp杂化 3 NA或3×6.02×1023个
(2)NH3分子间存在氢键
(3)N2O
(4)CuCl CuCl+2HCl===H2CuCl3(或CuCl+2HCl===H2[CuCl3])


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某烯烃与氢气加成后得到2,2﹣二甲基丁烷,则该烯烃的名称是( )
|
| A. | 3,3﹣二甲基﹣1﹣丁烯 | B. | 2,2﹣二甲基﹣2﹣丁烯 |
|
| C. | 2,2﹣二甲基﹣1﹣丁烯 | D. | 2,2﹣二甲基﹣3﹣丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一瓶乙二醇和丙三醇的混合物,已知它们的性质如下表,据此,将乙二醇和丙三醇互相分离的最佳方法是( )
| 物质 | 分子式 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) | 溶解性 |
| 乙二醇 | C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
| 丙三醇 | C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.萃取法 B.结晶法
C.分液法 D.分馏法
查看答案和解析>>
科目:高中化学 来源: 题型:
纳豆是一种减肥食品,从纳豆中分离出一种由C、H、O 3种元素组成的有机物A,为确定其结构,现进行如下各实验:
①6.0 g物质A在一定条件下完全分解,生成3.36 L(标准状况)一氧化碳和1.8 g水;
②中和0.24 g物质A,消耗0.20 mol·L-1的氢氧化钠溶液20.00 mL;
③0.01 mol物质A完全转化为酯,需乙醇0.92 g;0.01 mol A能与足量钠反应放出0.336 L标准状况下的氢气。
试确定:
(1)A的摩尔质量及化学式。
(2)A的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
NaCl晶体模型如图所示,在NaCl晶NaCl的晶体结构体中,每个Na+周围同时吸引________个Cl-,每个Cl-周围也同时吸引着________个Na+;在NaCl晶胞中含有________个Na+、________个Cl-,晶体中每个Na+周围与它距离最近且相等的Na+共有________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X、Y的元素符号依次为________、________;
(2)XZ2与YZ2分子的立体构型分别是________和________,相同条件下两者
在水中的溶解度较大的是________(写分子式),理由是__________________;
(3)Q的元素符号是________,它属于第________周期,它的核外电子排布式
为____________________________,在形成化合物时它的最高化合价为
________;
(4)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在制玻璃的原料中,再加入下列物质后,可制得各种不同用途的玻璃:
A.氧化亚铜(Cu2O) B.氧化钴(Co2O3)
C.氧化铅(PbO) D.硼砂(Na2B4O7·10H2O)
(1)制造化学仪器的玻璃需加入的物质是______。
(2)制造光学仪器的玻璃需加入的物质是______。
(3)制造蓝色玻璃需加入的物质是____________。
(4)制造红色玻璃需加入的物质是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | △H<0、△S>0的反应在温度低时不能自发进行 |
|
| B. | NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
|
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 |
|
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com