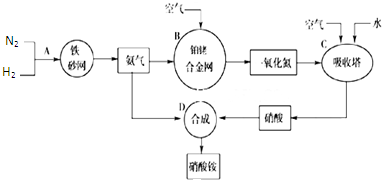
分析:(1)根据工业生产中,氢气来自水煤气,反应原理是:C+H
2O
CO+H
2;为防止催化剂中毒,必须对原料进行净化;
(2)由外界条件对化学平衡以及化学反应速率的影响分析;
(3)装置B是氨催化氧化反应,是氨气在催化剂铂铑合金作用下被氧气氧化为一氧化氮的反应;
(4)据反应化学方程式反应物和生成物的性质和经济效益分析,绿色化学为无污染,原子利用率高的生产;
(5)根据NH
3制NO的产率是96%、NO制HNO
3的产率是92%,利用氮原子守恒来计算硝酸的量,再由HNO
3跟NH
3反应生成NH
4NO
3来计算氨气的量,最后计算制HNO
3所用去的NH
3的质量占总耗NH
3质量的百分数;
(6)硝酸铵受撞击时易分解产生气体,在有限空间内,气体急速膨胀,易爆炸.
解答:
解:(1)根据工业生产中,氢气来自水煤气,反应原理是:C+H
2O
CO+H
2;工业上在合成氨的过程中,必须对原料进行净化,防止催化剂铁触媒中毒,而减小催化活性,故答案为:C+H
2O
CO+H
2;防止催化剂中毒;
(2)合成氨反应的化学方程式为:N
2(g)+3H
2(g)?2NH
3(g)△H=-92.2kJ/mol,反应物气体的化学计量数大于生成物气体的化学计量数,则加压有利于平衡正向移动,提高原料气的转化率,升高温度虽然不利于平衡向正反应方向移动,但能增大反应速率,缩短达到平衡的时间.
合成硝酸的吸收塔中通入空气的目的是利用一氧化氮和氧气按照4:3全部反应生成硝酸;4NO+3O
2+2H
2O=4HNO
3,可使NO循环利用,全部转化成HNO
3;
故答案为:加压使化学反应速率加快,有利于平衡正向移动,提高原料气的转化率;可使NO循环利用,全部转化成HNO
3;
(3)装置B是氨催化氧化反应:氨气在催化剂作用下被氧气氧化为一氧化氮的反应,反应的化学方程式为:4NH
3+5O
2 4NO+6H
2O;
故答案为:4NH
3+5O
2 4NO+6H
2O;
(4)碱液吸收法:NO+NO
2+2NaOH═2NaNO
2+H
2O,NH
3还原法:8NH
3+6NO
2 7N
2+12H
2O,分析可知碱液吸收法消耗大量的氢氧化钠生成的亚硝酸盐毒,NH
3还原法产物无污染,得到合成氨的原料气,故符合绿色化学的是氨气还原法,故答案为:氨气还原法;
(5)由NH
3制NO的产率是96%、NO制HNO
3的产率是92%,根据氮原子守恒可知,NH
3~NO~HNO
3,则1mol氨气可得到硝酸1mol×96%×92%=0.8832mol,由HNO
3+NH
3═NH
4NO
3,则该反应消耗的氨气的物质的量为0.8832mol,氨气的质量之比等于物质的量之比,则制HNO
3所用去的NH
3的质量占总耗NH
3质量的百分数为
×100%=53.1%;即制HNO
3所用去的NH
3的质量占总耗NH
3质量的53.1%,故答案为:53.1;
(6)由于硝酸铵受撞击时易爆炸,因此硝酸铵不能与易燃物混放;不能用铁锤等物将结块的硝酸铵砸碎;不能受到严重撞击,NH
4NO
3N
2O↑+2H
2O;铵盐水解显酸性不能和水解显碱性的草木灰混合使用,硝酸铵是易溶于水的物质易在土壤中流失;
①不能与碱性肥料混施;硝酸铵溶液呈碱性;
②不能剧烈撞击;硝酸铵易爆炸;
③不能在雨水较多的地区使用;硝酸铵吸水性强,易流失;
故答案为:①不能与碱性肥料混施;硝酸铵溶液呈碱性;
②不能剧烈撞击;硝酸铵易爆炸;
③不能在雨水较多的地区使用;硝酸铵吸水性强,易流失(任选两条).