
分析 钠性质活泼,常温下与氧气反应生成氧化钠、在加热条件下与氧气反应生成过氧化钠,Mg、Al、Fe与02在加热或点燃条件下反应,分别生成氧化镁、氧化铝以及四氧化铁,以此解答.
解答 解:钠性质活泼,常温下与氧气反应生成氧化钠、在加热条件下与氧气反应生成过氧化钠,方程式分别为4Na+O2=2Na2O、2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2,
镁在氧气中燃烧生成氧化镁,方程式为2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO,
铝在加热条件下与氧气反应生成氧化铝,方程式为2Al+3O2$\frac{\underline{\;加热\;}}{\;}$2Al2O3,
铁在氧气中燃烧可生成四氧化三铁,方程式为3Fe+2O2$\frac{\underline{\;加热\;}}{\;}$Fe3O4,
故答案为:4Na+O2=2Na2O、2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2;2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;2Al+3O2$\frac{\underline{\;加热\;}}{\;}$2Al2O3;3Fe+2O2$\frac{\underline{\;加热\;}}{\;}$Fe3O4.
点评 本题综合考查常见金属与氧气的反应,侧重学生的双基的考查,有利于培养学生良好的科学素养,注意把握反应的条件以及方程式的书写,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 钠与水的反应 Na+H2O═OH-+H2↑ | |
| B. | NaHCO3溶液与盐酸的反应 CO32-+2H+═H2O+CO2↑ | |
| C. | 用FeCl3溶液腐蚀铜线路板 Cu+Fe3+═Cu2++Fe2+ | |
| D. | AlCl3溶液中加入过量氢氧化钠溶液 Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素 | B. | 单质 | C. | 原子 | D. | 分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
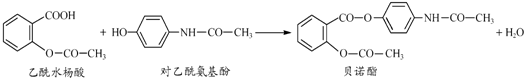
 .
.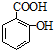 ,请写出两步反应中依次
,请写出两步反应中依次查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当x=n时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- | |
| B. | 当x=2n,反应的离子方程式为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| C. | 当x>n时,Fe2+和I-均被氧化 | |
| D. | 氧化性顺序:Cl2>I2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 电解质 | Ka1 | Ka2 |
| H2S | 1.3×10-7 | 7.1×10-15 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三氧化硫溶于水,溶液显酸性:SO3+H2O═H2SO3 | |
| B. | 用稀硫酸除去铁表面的铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 漂白粉在空气中放置变质:Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | |
| D. | 用盐酸除铜锈[Cu2(OH)2CO3]:Cu2(OH)2CO3+4H+═2Cu2++3H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com