
分析 (1)根据M=$\frac{m}{n}$计算混合气体的平均摩尔质量;
(2)CO2通入Na2CO3溶液中,发生Na2CO3+CO2+H2O=2NaHCO3,20℃时,Na2CO3溶解度为21.8g,NaHCO3溶解度为9.6g,根据反应方程式以及21.2gNa2CO3溶于103.6g水中配成溶液的条件求解,沉淀为NaHCO3,结合数据求解析出晶体的质量.
解答 解:(1)混合气体在标准状况下的体积为17.92L,物质的量为n=$\frac{17.92L}{22.4L/mol}$=0.8mol,混合气体平均摩尔质量=$\frac{28g}{0.8mol}$=35g/mol,故答案为:35g/mol;
(2)21.2gNa2CO3的物质的量为n=$\frac{m}{M}$=$\frac{21.2g}{106g/mol}$=0.2mol,在Na2CO3溶液中通入足量二氧化碳气体发生Na2CO3+CO2+H2O=2NaHCO3,0.2molNa2CO3消耗0.2molH2O,生成0.4molNaHCO3,m(NaHCO3)=nM=0.4mol×84g/mol=33.6g,剩余水为:103.6g-0.2mol×18g/mol=100g,NaHCO3溶解度为9.6g,应溶解9.6gNaHCO3,析出NaHCO3:33.6g-9.6g=24g,
故答案为:24.
点评 本题考查物质的量的相关计算,侧重于学生的计算能力的考查,注意对公式的理解,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以X浓度变化表示的反应速率为0.01mol•L-1•S-1 | |
| B. | 将容器体积变为2L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、I2、HI平衡混合气体加压颜色变深 | |
| B. | 氯水光照颜色变浅 | |
| C. | NO2、N2O4混合气体加热颜色变深 | |
| D. | FeCl和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
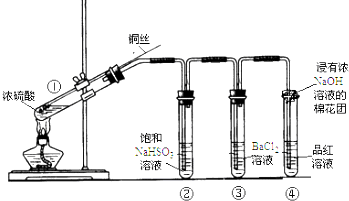
| 加入试剂 | 现象 | 反应的离子方程式 | |
| 第一份 | 加入NaOH溶液 | 有白色沉淀生成 | SO2+2OH-═SO32-+H2OBa2++SO32-═BaSO3↓ |
| 第二份 | 加入氯水 | 有白色沉淀生成 | SO2+Cl2+H2O═4H++2Cl-+SO42-Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{1}$ | B. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{4}{1}$ | C. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{1}{4}$ | D. | $\frac{n(S{O}_{2})}{n({H}_{2})}$=$\frac{3}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
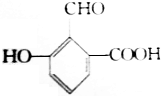 具有的三种官能团分别是:羟基、醛基和羧基,所以这种化合物可看作酚类、醛类和羧酸类.
具有的三种官能团分别是:羟基、醛基和羧基,所以这种化合物可看作酚类、醛类和羧酸类.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com