
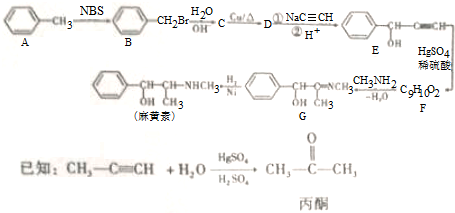

 ,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种)
,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构有12种,其中核磁共振氢谱显示有四组峰的结构简式为(任写~种) 或
或 .
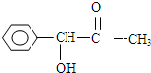
.分析 根据题中各物质转化关系,A中甲基上的氢原子发生取代反应生成B,B在碱性条件下发生水解得C为 ,C发生氧化反应得D为
,C发生氧化反应得D为 ,D与乙炔钠发生加成反应再酸化得E,根据F的分子式可知,E在硫酸汞作用下与水反应生成F为
,D与乙炔钠发生加成反应再酸化得E,根据F的分子式可知,E在硫酸汞作用下与水反应生成F为 ,据此答题.
,据此答题.
解答 解:根据题中各物质转化关系,A中甲基上的氢原子发生取代反应生成B,B在碱性条件下发生水解得C为 ,C发生氧化反应得D为
,C发生氧化反应得D为 ,D与乙炔钠发生加成反应再酸化得E,根据F的分子式可知,E在硫酸汞作用下与水反应生成F为
,D与乙炔钠发生加成反应再酸化得E,根据F的分子式可知,E在硫酸汞作用下与水反应生成F为 ,
,
(1)根据上面的分析可知,A到B的反应类型是取代反应,故答案为:取代反应;
(2)根据E的结构简式可知,E中官能团名称为羟基和碳碳三键,故答案为:羟基和碳碳三键;
(3)D为 ,D与银氨溶液反应的化学方程式为
,D与银氨溶液反应的化学方程式为 ,
,
故答案为: ;
;
(4)根据上面的分析可知,F的结构简式是 ,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构为苯环上连有HCOO-、-CH2CH3或CH3COO-、-CH3或-COOCH3、-CH3或HCOOCH2-、-CH3,每种结构各有邻间对三种,所以共有12种,其中核磁共振氢谱显示有四组峰的结构简式为
,H是F的同分异构体,H中含有苯环,苯环上只有两个取代基,并且能发生水解反应,则H的可能结构为苯环上连有HCOO-、-CH2CH3或CH3COO-、-CH3或-COOCH3、-CH3或HCOOCH2-、-CH3,每种结构各有邻间对三种,所以共有12种,其中核磁共振氢谱显示有四组峰的结构简式为 或
或 ,
,
故答案为: ;12;
;12; 或
或 ;
;
(5)根据G的结构简式可知,G中含有苯环、羟基、碳氮双键,所以G能发生加成反应、酯化反应、能使酸性高锰酸钾溶液褪色,G中有氮原子,有孤电子对,能与盐酸反应,G中羟基邻位碳上没有氢原子,所以不能发生消去反应,
故选a、b、c、d.
点评 本题考查了有机物的推断及合成,明确有机物的官能团及其性质是解本题关键,了解典型的有机反应类型,知道有机反应中断键和成键位置,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
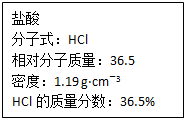 (1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为48.3%.
(1)在同温、同压下,实验测得CO、N2和O2三种气体的混合气体的密度是H2的14.5倍,其中O2的质量分数为27.6%.若其中CO和N2的物质的量之比为1:1,则混合气体中氧元素的质量分数为48.3%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N具有相同的中子数 | B. | 13C与C60是同一种物质 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Br的电子式: | |
| B. | CO2的比例模型: | |
| C. | CCl4分子构型为正四面体,其键与键之间的夹角为109°28′ | |
| D. | 中子数为20的氯原子:20Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,晶体类型为分子晶体.
,晶体类型为分子晶体.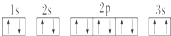 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(OH-)=0.001mol•L-1 | B. | 溶液中c(H+ )=10-11 mol•L-1 | ||
| C. | 由水电离出的c(H+ )=0.1mol•L-1 | D. | c(HCO3-)<c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com