
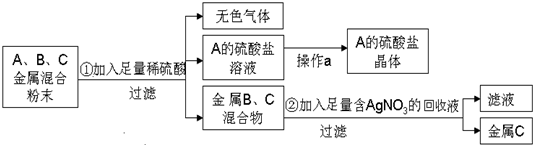
分析 Cu、Ag都为不活泼金属,能与稀硫酸反应的只有Mn,则A为Mn,生成无色气体为氢气,B、C为Cu、Ag的混合物,Cu比Ag活泼,混合物加入硝酸银溶液,铜硝酸银反应,得到的金属C为Ag,滤液中含有硝酸铜,以此解答该题.
解答 解:由以上分析可知A为Mn,B为Cu,C为Ag,
(1)活泼性Mn>Cu>Ag,即活动性顺序为A>B>C,故答案为:A;B;C;
(2)由以上分析C为银,由溶液得到晶体,可用结晶的方法,故答案为:银; 蒸发、结晶;
(3)Mn和稀硫酸反应生成硫酸锰和氢气,反应的化学方程式为 Mn+H2SO4=MnSO4+H2↑,故答案为:Mn+H2SO4=MnSO4+H2↑.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质的异同以及金属活动性的强弱,难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
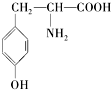 营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容.已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是:
营养品和药品都是保证人类健康不可缺少的物质,其性质和制法是化学研究的主要内容.已知酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式是: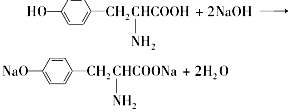 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O3 | B. | NO2 | C. | N2O | D. | N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量浓度的NaCl和AlCl3混合液完全电解后,所得的混合液的pH值增大 | |
| B. | NaCl溶液电解一定时间后,要恢复到电解前状态,应加入适量盐酸 | |
| C. | Na2SO4溶液在电解过程中,阴极区pH值降低 | |
| D. | 电解CuSO4溶液,阳极反应式为:2H2O+O2+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| B. | 1mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 | |
| C. | 7.8gNa2O2与过量水反应转移电子数为0.1NA | |
| D. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当有3NA个电子转移时,△H变为-46.2kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com