
下列关于丙烯(CH3—CH =CH2)的说法正确的( )。
A. 丙烯分子中3个碳原子都是sp3杂化。 B. 丙烯分子有8个δ键,1 个∏键。
C. 丙烯分子中3个碳原子在同一直线上。 D. 丙烯分子不存在非极性键。
 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色)回答下列问题:
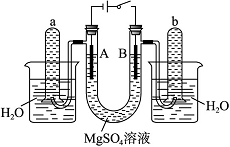
(1)下列关于电解过程中电极附近溶液颜色变化的叙 述正确的是______(填编号);
述正确的是______(填编号);
①A管溶液由红变黄
②B管溶液由红变黄
③A管溶液不变色
④B管溶液不变色
(2)写出 A管中发生反应的反应式:____________________________________________; (3)写
A管中发生反应的反应式:____________________________________________; (3)写 出B管中发生反应的反应式:____________________________________________;
出B管中发生反应的反应式:____________________________________________;
(4)检验a管中气体的方法是_ __________________________________________________;
(5)检验b管中气体的方法是_________________________________________________;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.乙烯中C=C的键能是乙烷中C—C的键能的2倍
B.同一原子中,2p,3p,4p能级的轨道依次增多
C. C—O键的极性比N—O键的极性大
D.NH4+中4个N—H键的键能不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1)氮元素基态原子的价电子排布式为 ;
(2)在氮气分子中,氮原子之间存在着 个σ键和————个π键;
(3)氮、氧、氟是同周期相邻的三种元素,比较:
①氮原子的第一电离能 (填“大于”、“小于”或“等于”)氧原子的第一电离能;
②氮原子的电负性 (填“大于”、“小于”或“等于”) 氧原子的电负性;
(4)氮元素的氢化物——NH3是一种易液化的气体,该气体易液化的原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
铵盐是一类重要的氮的化合物,设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )。
A.1 mol NH4+含有的电子数为11NA
B.NH4+中N元素的化合价为-3,在氧化还原反应中常作氧化剂
C.0.1 L 3 mol·L-1的NH4NO3溶液中氮原子数等于0.6NA
D.硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
水是一种宝贵的自然资源。
(1)生活污水中,常含N、P化合物而造成水体植物富营养化污染。水中的氨在微生物的作用下,可发生以下一系列变化:A、 NH3 + O2 →HNO2+ H2O(未配平)
B、2HNO2+O2 → 2HNO3,回答以下问题
① 配平反应A并标出电子转移的方向与数目:
____NH3+ ___O2 → ___HNO2+ ____ H2O
② 反应B中被氧化的元素是 。
(2)氧化还原法是处理污水常用的方法之一。某工厂排放的污水,经检测,污水中含有
0.012 mol/L的游离态溴,可用Na2SO3还原除去污水中的溴,请写出其离子方程式:
若处理5L这种污水,至少需加入0.05mol/L的Na2SO3溶液 L才能将单质溴全部除去。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com