
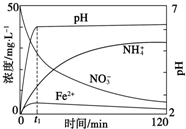
 工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.
工、农业废水及生活污水中浓度较高的NO${\;}_{3}^{-}$会造成氮污染,工业上处理水体中NO${\;}_{3}^{-}$的一种方法是单质铁化学还原法.某化学小组用废铁屑和硝酸盐溶液模拟此过程,实验如下.分析 (1)①除锈是用强酸与氧化铁反应;②可以通测最后一次洗涤液的PH的方法成功判断铁屑是否洗净;
(2)硝酸根离子在酸性条件下才具有强氧化性;
(3)①根据图示知道t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则是金属铁和硝酸之间的反应;②亚铁离子属于弱碱阳离子,会发生水解反应.
解答 解:(1)①除锈是用强酸与氧化铁反应,所以离子方程式反应为:Fe2O3+6H+=2Fe3++3H2O,铁屑洗净的方法是测最后一次洗涤液的PH的方法成功判断铁屑是否洗净,故答案为:测最后一次洗涤液的pH,若为7则说明铁屑已洗净;
(2)pH调至2.5,是因为硝酸在酸性条件下的氧化性强,易被铁屑还原,故答案为:硝酸在酸性条件下的氧化性强,易被铁屑还原;
(3)①根据图示知道t1时刻前,硝酸根离子、氢离子浓度逐渐减小,亚铁离子浓度增大,则是金属铁和硝酸之间的反应,即4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
故答案为:4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
②根据反应:4Fe+NO3-+10H+=4Fe2++NH4++3H2O,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,原因是生成的Fe2+水解所致,
故答案为:生成的Fe2+水解.
点评 本题考查了化学方程式的书写、化学反应速率的影响因素、化学实验方案的判断等知识,题目难度较大知识点较多、综合性强,熟练掌握知识的迁移和应用是解答本题的关键,试题培养了学生的分析、理解能力及灵活应用所学知识的能力.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③④⑤ | C. | ②④⑤ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3)3CCH2CH3 | ||
| C. | (CH3)2CHCH2CH2CH(CH3)2 | D. | (CH3)2CHCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是酸性溶液 | B. | 一定是碱性溶液 | ||
| C. | 可能是中性溶液 | D. | 可能是酸性溶液也可能是碱性溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 | |
| B. | 24Cr原子的电子排布式是1s22s22p63s23p63d44s2 | |
| C. | 所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 | |
| D. | 价电子排布为5s25p1的元素位于第五周期第ⅠA族,是s区元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1L 1 mol•L-1 的氯化钠溶液中取出10ml后,其浓度仍是1 mol•L-1 | |
| B. | NaHSO4溶液与NaOH溶液反应的离子方程式:H++OH-═H2O | |
| C. | 黄河入海口处三角洲的形成与胶体性质无关 | |
| D. | 氧化剂具有氧化性,在化学反应中化合价降低,发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com