

| A、实验时先加H2O2后加MnO2有利于增大固液接劁 |
| B、为使实验顺利进行,H2O2不宜从图Ⅱ漏斗处加入 |
| C、Ⅱ、Ⅲ处均可观察到迅速产生大量气泡,余烬复燃 |
| D、上述流程中不宜先加入MnO2再插入带余烬的木条 |


科目:高中化学 来源: 题型:
| A、相同温度下,HF比HCN易电离,则等浓度NaF溶液的pH值比NaCN溶液的pH值大 |
| B、Na2CO3溶液加水稀释过程中,水解平衡正向移动,溶液的pH增大 |
| C、常温下,0.l mol/L的下列溶液:①NH4HSO4②NH4Cl③NH3?H2O④CH3COONH4溶液中,c(NH4+)由大到小的顺序是:①>②>③>④ |
| D、酸碱滴定曲线能够表明酸碱中和过程中溶液的pH值变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH相同的①CH3COONa、②NaHCO3、③Na2CO3三份溶液中的c(Na+):③>②>① |
| B、0.1mol?L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
C、如图中pH=7时:c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
D、如图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时,负极的电极反应式为:Pb-2e-═Pb2+ |
| B、放电时,正极得电子的物质是PbO2 |
| C、充电时,电解质溶液中硫酸浓度减小 |
| D、充电时,阴极的电极反应式为:PbSO4-2e-+2H2O═PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 固体混合物 | 除杂方法或除杂试剂 |
| ① | Na2CO3(NaHCO3) | |
| ② | Fe2O3(Al2O3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
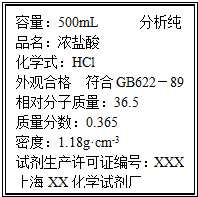 取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.
取质量为14.8g的Na2CO3和NaHCO3的固体混合物,与100mL 2.50mol?L-1的盐酸恰好完全反应不再放出气体.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁与稀硫酸反应:Fe+6H+=2Fe3++3H2↑ |
| B、用稀盐酸除铁锈:Fe2O3+6H+=2Fe3++3H2O |
| C、碳酸钙与稀盐酸反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D、氢氧化钡溶液与硫酸溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.20 | 0.10 | 0.40 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com