
【题目】在一定条件下,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图。回答下列问题:

(1)该反应的化学方程式为 。
(2)0~t1 s内A气体的反应速率为 。
(3)反应后与反应前的压强之比为 。
(4)(t1+10)s时,A气体的体积分数为 ,此时v(A)正 v(B)逆(填“>”、“<”或“=”)。
(5)关于该反应的说法正确的是 。
a.到达t1时刻该反应已停止
b.在t1时刻之前B气体的消耗速率大于它的生成速率
c.在t1时刻C气体的正反应速率等于逆反应速率
科目:高中化学 来源: 题型:
【题目】M是日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质间的转化关系如下图所示(部分产物已略去)

(1)若A是地売中含量最多的金属元素,将A的氯化物溶液和氢氧化钠溶液等体积混合,得到的沉淀物中A元素与溶液中A元素的质量相等,则A的该氯化物溶液和氢氧化钠溶液的物质的量浓度之比可能为____________。
(2)若A是CO2气体,A与B溶液反应后所得的溶液再与盐酸反应,放出气体的物质的量与所加盐酸体积之间的关系如图所示:则A与B溶液反应后溶液中的溶质为___________(填化学式),物质的量之比为_______。

(3)若A是一种正盐,A能分别与B、F溶液反应生成无色且具有刺激性气味的气体,则A的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于烃 的说法正确的是
的说法正确的是
A. 共面的C原子最多为14个
B. 共直线的C原子只有为4个
C. 1mol该烃最多可以和6molH2发生加成反应
D. 1mol该烃最多可以消耗6molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上有一种加酶洗衣粉,它是在洗衣粉中加入少量的碱与蛋白酶制成的。蛋白酶的催化活性很强,衣物的汗渍、血迹及入体排放的蛋白质,油渍遇到它,都能水解而除去。下列衣料中,不能用加酶洗衣粉洗涤的是:
①棉成品 ②毛织品 ③腈纶织品 ④丝织品
A.②④B.②③C.①③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B的氢化物形成六配位的配合物,有两个氯离子位于外界。
请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为____。
(2)B的氢化物的分子空间构型是____。
(3)写出AC2的电子式____;其中心原子采取____杂化。
(4)ECl3形成的配合物的化学式为____,1mol该配合物中σ键数目为____mol。
(5)B的氢化物易液化的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、101kPa时,1gCH4完全燃烧生成液态水时放出的热量是55.64 kJ,则表示甲烷燃烧热的热化学方程式是___________________________________________。
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)===3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ· mol-1,已知CO气体燃烧的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-565.14 kJ·mol-1,试计算相同物质的量的C3H8和CO燃烧产生的热量的比值________(保留小数点后一位)。
(3)氢气既能与氮气发生反应又能与氧气发生反应,但是反应的条件却不相同。
已知:2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ· mol-1
3H2(g)+N2(g)![]() 2NH3(g) ΔH=-92.4 kJ· mol-1
2NH3(g) ΔH=-92.4 kJ· mol-1

计算断裂1 mol N≡N键需要消耗能量________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)已知反应NO2(g)+CO(g) = NO(g) +CO2(g)的能量变化如图所示,下列说法正确的是________。
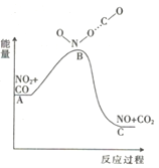
A.图中A→B的过程为放热过程
B.1molNO2和1molCO的键能总和大于1molNO和1molCO2的键能总和
C.该反应为氧化还原反应
D.1molNO2(g)和1molCO(g)的总能量低于1molNO(g)和1molCO2(g)的总能量
(2)N2O4与NO2之间存在反应N2O4(g)![]() 2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[a(N2O4)]随温度的变化如图所示。
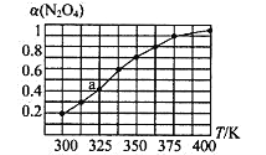
①由图推测该反应的△H___0(填“>”或“<”),理由为________________。
②图中a点对应温度下,已知N2O4的起始压强为108 kPa,则该温度下反应的平衡常数Kp=_________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
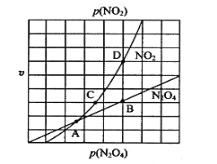
③在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v( N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率压强关系如图所示,一定温度下,k1、k2与平衡常数Kp的关系是k1=___________,在下左图上标出的点中,能表示反应达到平衡状态的点为__________(填字母代号)。
(3)以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH3)4NOH],装置如图所示。
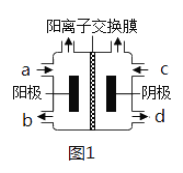
①收集到(CH3)4NOH的区域是______(填a、b、c或d)。
②写出电解池总反应(化学方程式)___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )

A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应剧烈
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2=2H2O,下列有关说法正确的是( )

A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. H+由a极通过固体酸电解质传递到b极
D. 每转移0.2 mol电子,消耗1.12 L的H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com