
| A. | 71 g KO2 中所含离子数为 1.806×1024 | |
| B. | 标准状况下,22.4 L 环己烷分子中含 7.224×1024 个 C-H 键 | |
| C. | C2H4 分子中极性键和非极性键的比值为 4:1 | |
| D. | COCl2 和 BF3 分子中所有原子的最外层都达到 8 电子稳定结构 |
分析 A.根据n=$\frac{m}{M}$计算物质的量,KO2 是1个钾离子和1个O2-离子构成;
B.标准状况下,环己烷为液态,无法计算;
C.根据C2H4 的结构简式为CH2=CH2分析;
D.分子中原子价电子数加上化合价的绝对值即是该原子的最外层电子数.
解答 解:A.71 g KO2 固体物质的量=$\frac{71g}{71g/mol}$=1mol,KO2 是1个钾离子和1个O2-离子构成,则离子的物质的量为2mol,所以所含离子数约为1.204×1024,故A错误;
B.标准状况下,环己烷为液态,无法计算,所以不能计算分子中的C-H 键数,故B错误;
C.C2H4 的结构简式为CH2=CH2,分子中含有1个C=C非极性键和4个C-H极性键,则极性键和非极性键的比值为4:1,故C正确;
D.COCl2分子中所有原子的最外层都达到8电子稳定结构,BF3 分子中B原子的最外层电子数为6,故D错误;
故选C.
点评 本题考查了物质的量的计算、气体摩尔体积、8电子稳定结构、极性键和非极性键等,题目涉及的知识点较多,侧重于基础知识的应用的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 制普通玻璃的原料主要是纯碱、石灰石和石英 | |
| B. | 普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅 | |
| C. | 玻璃在加热熔化时有固定的熔点 | |
| D. | 盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 皂化反应与乙酸乙酯水解的反应属于同一类型的反应 | |
| B. | 裂化汽油、植物油、甘油均能与溴发生加成反应而使溴的四氯化碳溶液褪色 | |
| C. | 石油化工得到的产品均为液体,煤化工得到的产品有液体,也有固体 | |
| D. | 相同物质的量的乙烯和乙醇完全燃烧,乙醇消耗氧气的物质的量多于乙烯的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17 | B. | 25 | C. | 27 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
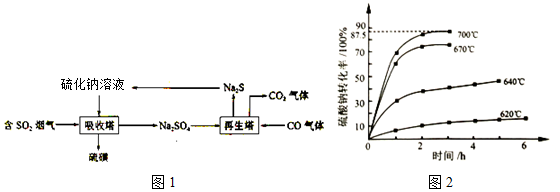
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com