
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 946 |
分析 (1)首先写出FeO(s)被CO还原成Fe和CO2的热化学方程式CO(g)+FeO(s)=Fe(g)+CO2(g)△H,利用盖斯定律①×3-(③×2+②)可得到该化学方程式,以此计算△H;
(2)根据△H=反应物键能和-生成物键能和求算;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=+393.5kJ/mol
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,①×4+②-③得到反应的热化学方程式为:4C(s,石墨)+2H2(g)=2C2H2(g),据此计算.
解答 解:①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol
依据盖斯定律①×3-(③×2+②)得到:
6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66kJ/mol;
得到热化学方程式为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol,
故答案为:CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-11kJ/mol;
(2)△H=反应物键能和-生成物键能和=946KJ/mol+3×436KJ/mol-6×391KJ/mol=-93KJ/mol,即a=-92,
故答案为:-92;
(3)已知:①C(s,石墨)+O2(g)=CO2(g)△H1=+393.5kJ/mol
②2H2(g)+O2(g)=2H2O (l)△H2=-571.6kJ/mol
③2C2H2(g)+5O2(g)=4CO2(g)+2H2O (l)△H3=-2599kJ/mol
根据盖斯定律,①×4+②-③得到反应的热化学方程式为:4C(s,石墨)+2H2(g)=2C2H2(g) △H=+453.4kJ•mol-1;
热化学方程式为:2C(s,石墨)+H2(g)=C2H2(g) △H=+226.7kJ•mol-1,
故答案为:+226.7kJ•mol-1.
点评 本题考查了热化学方程式书写方法和盖斯定律的计算应用、利用键能计算反应热,题目难度中等,注意把握盖斯定律的含义和应用方法,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:多选题
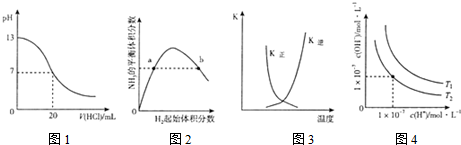
| A. | 图1表示25℃时,用0.lmol L-1盐酸滴定20mL 0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图2表示一定条件下的合成氨反应中.NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点 | |
| C. | 图3表示恒容密闭容器中反应“2SO2(g)+O2(g)?2SO3(g)△H<0”的平衡常数K正、K逆随温度的变化 | |
| D. | 图4表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数 | B. | 压强 | C. | 密度 | D. | 平均摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 | 20.00 | 0.10 | 24.18 |
| 2 | 20.00 | 0.10 | 23.06 |
| 3 | 20.00 | 0.10 | 22.96 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Fe3+ | B. | HCO3-、Al3+ | C. | Ba2+、SO42- | D. | Na+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com