
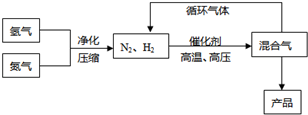
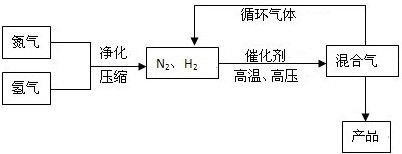
(Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)![]() 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:

回答下列问题:
⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
Ⅱ:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa
时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ,写出表示N2H4燃烧热的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。肼—空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式 。
(3)图是一个电化学过程示意图。
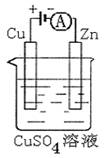
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 3 |
| O | - 3 |
| H | + 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)![]() 2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
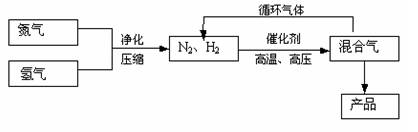
反应体系中各组分的部分性质见下表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度升高,
K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省高三5月高考冲刺理科综合化学试卷(解析版) 题型:填空题
(8分)【化学-化学与技术】
工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下:
2NH3(g);△H=-92.44 kJ/mol;其部分工艺流程如下:
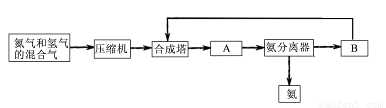
(1)合成氨所需要的原料气中,氮气取自 ,氢气来源于 。
(2)对原料气进行净化处理的目的是 。
(3)设备A的名称是 ,设备B的名称是 。
(4)在10~30Mpa时,工业合成氨选择400~500 ℃的温度进行反应,主要原因是 。
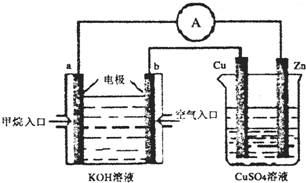
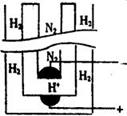
(5)据《科学》杂志报道,希腊化学家在常压下将氢气和用氢气稀释的氮气分另通入一个加热到570 ℃的电解池(如图)中,氢和氮在电极上合成了氨,且转化率达到了78%。
则阳极反应为 ,阴极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com