
| A£®NaCNŗĶHCN ĪļÖŹµÄĮæ±Č1©U1×é³ÉµÄ»ģŗĻČÜŅŗ³ŹĖįŠŌ |
| B£®ĪļÖŹµÄĮæÅØ¶Č¾łĪŖ0.1mol”¤l£1µÄNaF”¢NaNO2”¢NaCNČÜŅŗµÄpHÖš½„Ōö“ó |
| C£®øł¾ŻÉĻŹöijĮ½øö·“Ó¦¼“æÉµĆ³öµēĄė³£Źż“󊔵ĽįĀŪ |
| D£®µēĄė³£ŹżĪŖ£ŗK(HCN)<K(HNO2)<K(HF) |



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®c(Na+)©c(CN-)©H+ ()©c(OH-) | B£®c(HCN)+c(CN-)=0.04mol”¤L-1 |
| C£®c(Na+)+c(H+)=c(CN-)+c(OH-) | D£®c(CN-)©c(HCN) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
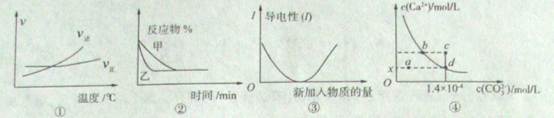
A£®øł¾ŻĶ¼¢ŁæÉÅŠ¶ĻæÉÄę·“Ó¦A2(g)+3B2(g)  2AB3(g)µÄ”÷H>O 2AB3(g)µÄ”÷H>O |
B£®Ķ¼¢Ś±ķŹ¾Ń¹Ēæ¶ŌæÉÄę·“Ó¦2A(g)+2B(g)  3C(g)+D(s)µÄÓ°Ļģ£¬ŅŅĒśĻß±ķŹ¾µÄŃ¹Ēæ“ó 3C(g)+D(s)µÄÓ°Ļģ£¬ŅŅĒśĻß±ķŹ¾µÄŃ¹Ēæ“ó |
| C£®Ķ¼¢ŪæɱķŹ¾ŅŅĖįČÜŅŗÖŠĶØČė°±ĘųÖĮ¹żĮæ¹ż³ĢÖŠČÜŅŗµ¼µēŠŌµÄ±ä»Æ |
| D£®ŹŅĪĀŹ±£¬CaC03ŌŚĖ®ÖŠµÄ³ĮµķČܽāĘ½ŗāĒśĻßČēĶ¼¢ÜĖłŹ¾£¬cµćŹ±ÓŠCaC03Éś³É |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ca2+”¢Al3+”¢CO32”„”¢AlO2ØD | B£®Cu2£«”¢Cl£”¢Na£«”¢NO3ØD |
| C£®Fe2+”¢H+”¢SO42”„”¢NO3”„ | D£®Mg2£«”¢NO3£”¢K£«”¢Br£ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ÄĘĶ¶ČėĮņĖįĶČÜŅŗÖŠ£ŗ2Na+Cu2+===2Na++Cu |
| B£®Ģ¼ĖįøĘÓėŃĪĖį·“Ó¦£ŗCaC03+2H+===Ca2++C02”ü+H20 |
| C£®ĮņĖįÓėĀČ»Æ±µ·“Ó¦£ŗSO2-4+Ba2+===BaSO4”ü |
| D£®ĀČĘųĶØČĖĖ®ÖŠ£ŗCl2+H20===H++Cl-+HCl0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ŹµŃé¹ż³ĢÖŠĖ®µÄµēĄė³Ģ¶ČŹĒĻČ¼õŠ”ŗóŌö“ó |
| B£®µ±µĪ¼ÓŃĪĖįÖĮČÜŅŗpH<7Ź±£¬ČÜŅŗÖŠČÜÖŹŅ»¶ØŹĒHClŗĶNH4Cl |
| C£®µ±µĪ¼ÓŃĪĖįÖĮČÜŅŗpH=7Ź±£¬ČÜŅŗÖŠc(NH4+)>c(Cl-) |
| D£®µ±µĪ¼ÓŃĪĖįÖĮĒ”ŗĆĶźČ«ÖŠŗĶŹ±£¬c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®c(CH3COO-)£¾c(H+) = c(Na+)£¾c(OH-) | B£®c(Na+)£¾c(OH-) £¾c(CH3COO-)£¾c(H+) |
| C£®c(OH-)£¾c(Na+)£¾c(H+)£¾c(CH3COO-) | D£®c(Na+) £¾c(CH3COO-)£¾c(OH-) £¾c(H+) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®pH=1µÄČÜŅŗ£ŗNa+£¬NH4+”¢S2”Ŗ”¢NO3”Ŗ |
| B£®c£ØHSO2£©=0.1mol/LµÄČÜŅŗ£ŗK+”¢Ba2+”¢HCO”Ŗ”¢C1”Ŗ |
| C£®µĪČėÉŁĮæ±½ĖįĻŌ×ĻÉ«µÄČÜŅŗ£ŗNa+”¢K+”¢I”Ŗ”¢SO42”Ŗ |
| D£®ÄÜČܽāĢ¼·ÓøʵÄČÜŅŗ£ŗNa+”¢NH4+”¢C1”Ŗ”¢Br”Ŗ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com