
【题目】GaF3的熔点高于1000℃,GaCl3的熔点为77.9℃,其原因是________________________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.等量的铁分别与足量氯气和硫充分反应,生成物质的物质的量相同
B.等量的铜分别与足量浓、稀硝酸充分反应,生成气体的物质的量相同
C.等量的铝分别与氢氧化钠溶液和盐酸充分反应,生成气体体积一定相同
D.等量的氯气分别与足量氢氧化钠和硫化钠充分反应,转移的电子数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11;草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3 溶液的 pH________0.1 mol/L Na2C2O4 溶液的pH。(选填“大于”“小于”或“等于”)
等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
(2)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的 pH 变化不大,用平衡移动原理解释上述现象_________________________。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的 pH 变化不大,用平衡移动原理解释上述现象_________________________。
(3)请写出Na2CO3溶液中的微粒之间的关系式:
电荷守恒______________________,
质子守恒_______________________。
(4)已知 Ag2 CrO4、AgCl 的 Ksp 分别为 2.0×10-12和 2.0×10-10。在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与 CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中 Cl-恰好完全沉淀(浓度等于1.0×10-5 mol·L-1)时,溶液中 c(Ag+)为____________mol·L-1,此时溶液中 c(CrO42-)等于__________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中 A~G 均为中学化学中常见的物质,它们之间有如下转化关系。其中A、G 为非金属单质,A 为黑色固体、G 为气态;D、F 都是大气污染物,主要来源于汽车尾气,而且 D 为红棕色。

请回答以下问题:
(1)A 的元素在元素周期表中位于__________,C的化学式是_______________。
(2) 写出D与E反应转化为F和B的化学方程式_________________________。
(3)在常温下,B的稀溶液也可与Cu反应生成F。此反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HNO3与金属反应时,还原产物可能是NO2、NO、N2O、N2和NH3中的一种或几种。某同学取一定量的Al、Fe混合物,与2.0 L极稀的HNO3充分反应,假设HNO3的还原产物全部为铵盐。在反应后的溶液中,逐滴加入4 mol/L的NaOH溶液,所加NaOH溶液的体积与产生的沉淀的物质的量的关系如图所示。分析图像回答问题:
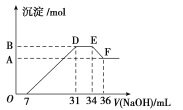
(1)与HNO3反应后Fe元素的化合价是________。
(2)DE段发生反应的离子方程式为:___________________。
(3)B点对应的沉淀的物质的量为________ mol。
(4)原硝酸溶液的物质的量浓度为________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,它们的原子序数依次增大,但均小于18,A和B在同一周期,A的电子式为![]() ,B原子L层的电子总数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
,B原子L层的电子总数是K层的3倍;0.1 mol C单质能从酸中置换出2.24 L氢气(标准状况),同时它的电子层结构变成与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同。
(1)写出A、B、C、D元素的名称:A________,B________,C________,D________。
(2)D元素在周期表中属第________周期第________族。
(3)用电子式表示A的气态氢化物的形成过程:_____________________。
(4)A和B的单质充分反应生成化合物的结构式是____________________。
(5)B与C形成的化合物是离子化合物还是共价化合物?如何证明?___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是
A.C(s)+O2(g)=CO2(g);△H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g);△H=-393.5kJ/mol
O2(g)=CO(g);△H=-393.5kJ/mol
C.C+O2=CO2;△H=-393.5kJ/mol
D.C(s)+O2(g)=CO2(g);△H=-393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是( )
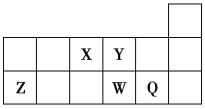
A.离子半径的大小顺序:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
B.最高价氧化物对应水化物的酸性:W比Q的强
C.元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D.X、Z、W、Q四种元素的最高价氧化物对应的水化物均能与强碱反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com